ИСПОЛЬЗОВАНИЕ КИНЕТИЧЕСКОГО МЕТОДА
ДЛЯ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ
ТИОСУЛЬФАТ-ИОНОВ НА ФОТОКОЛОРИМЕТРЕ КФК-2
Отчет о лабораторной работе
по курсу “Отраслевые технологические процессы”
ЯГТУ 200503.65-001 ЛР
Отчет выполнили
студенты гр. ЭСК-22
Тюрин И.________
Салехова П.______
Горбунова Е________
Лабораторная работа № 1
ИСПОЛЬЗОВАНИЕ КИНЕТИЧЕСКОГО МЕТОДА
ДЛЯ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ
ТИОСУЛЬФАТ-ИОНОВ НА ФОТОКОЛОРИМЕТРЕ КФК-2
| Цель работы: | определение концентрации тиосульфат-иона в анализируемом растворе на фотоколориметре КФК-2. |
| Реактивы: | исходные стандартные растворы: хлорида железа (С=0,003 моль/дм3), подкисленный соляной кислотой, роданида аммония (С=0,24 моль/дм3), тиосульфата натрия (С=0,004 моль/дм3), сульфата меди (С=0,015 моль/дм3). |
| Посуда: | мерные колбы вместимостью 50 см3, пипетки, секундомер, кювета (l =1 см). |
В основе определения концентрации тиосульфат-иона лежит окислительно-восстановительная реакция:
(CNS–)
Fe3+ + 2S2O32–  2Fe2+ + S4O
2Fe2+ + S4O 
Индикаторным веществом является роданид аммония, катализатором – соли меди (CuSO4).
Выполнение работы
1) Работу выполняют на фотоколориметре КФК-2. Порядок включения и работы на приборе смотри в разделе 1.2.
2) Выбирают светофильтр. В предварительно вымытую мерную колбу вместимостью 50 см3 отбирают пипеткой исходные растворы хлорного железа (5 см3), роданида калия (10 см3), тиосульфата натрия (10 см3), объем колбы доводят дистиллированной водой до метки, закрывают пробкой и тщательно перемешивают. Подготавливают две кюветы, одну заполняют приготовленным раствором, другую – дистиллированной водой. Помещают кюветы в кюветное отделение и измеряют абсорбцию раствора со всеми светофильтрами фотоколориметра. Выбирают светофильтр, при котором абсорбция раствора максимальна. Порядок фотометрирования смотри в разделе 1.3.
|
|
3) Подбирают оптимальную концентрацию катализатора (объем стандартного раствора сульфата меди). Время протекания химической реакции должно составлять ~ 20 мин. Приготавливают стандартные растворы с различным содержанием катализатора. В каждую колбу вместимостью 50 см3 отбирают раствор хлорного железа (5 см3), роданида калия (10 см3), тиосульфата натрия (10 см3) и раствор сульфата меди, например, в первую колбу – 0,8 см3 и проводят фотометрирование; во вторую – 0,9 см3; и в третью – 1,0 см3 и т.д. Исходный раствор катализатора сульфата меди следует разбавить в 10 раз. После добавления катализатора включают секундомер, затем доводят объем колбы дистиллированной водой до метки, закрывают пробкой, быстро и тщательно перемешивают. Заполняют кювету раствором, затем помещают ее в кюветное отделение фотоколориметра и измеряют абсорбцию через каждую минуту, записывают результаты в таблицу 1. В качестве раствора сравнения используют дистиллированную воду. Измерения заканчивают при абсорбции раствора, меньшей 0,1 отн.ед.
Таблица 1 - Выбор оптимальной концентрации катализатора
| Объем катализатора CuSO4, см3 | |||||||||
| V 1=0,2 | V 2=0,2 | V 3=0,2 | V4=0,2 | V5=0,2 | |||||
| Время, мин | Абсорбция, отн.ед. | Время, мин | Абсорбция, отн.ед | Время, мин | Абсорбция, отн.ед | Время, мин | Абсорбция, отн.ед. | Время, мин | Абсорбция, отн.ед. |
| 0,52 | 0,50 | 0,48 | 0,44 | 0,50 | |||||
| 0,50 | 0,46 | 0,44 | 0,40 | 0,44 | |||||
| 0,47 | 0,44 | 0,40 | 0,36 | 0,39 | |||||
| 0,44 | 0,40 | 0,37 | 0,32 | 0,35 | |||||
| 0,42 | 0,38 | 0,34 | 0,29 | 0,30 | |||||
| 0,40 | 0,35 | 0,31 | 0,26 | 0,27 | |||||
| 0,39 | 0,33 | 0,28 | 0,24 | 0,24 | |||||
| 0,37 | 0,30 | 0,26 | 0,20 | 0,20 | |||||
| 0,35 | 0,28 | 0,23 | 0,19 | 0,18 | |||||
| 0,34 | 0,27 | 0,22 | 0,17 | 0,16 | |||||
| 0,32 | 0,25 | 0,20 | 0,16 | 0,15 | |||||
| 0,31 | 0,23 | 0,18 | 0,15 | 0,14 | |||||
| 0,30 | 0,24 | 0,17 | 0,14 | 0,14 | |||||
| 0,28 | 0,20 | 0,16 | 0,13 | ||||||
| 0,27 | 0,15 | 0,13 | |||||||
| 0,26 | 0,14 | ||||||||
| 0,25 | 0,13 | ||||||||
| 0,24 | 0,13 | ||||||||
| 0,23 | |||||||||
| 5/10/10 | 5/10/11 | 5/10/12 | 5/10/13 | 5/10/14 | |||||
| Объем компонентов раствора, мл |
|
|
Если время протекания реакции превышает 20 мин (при V 1=0,8 см3), то необходимо приготовить второй стандартный раствор с большей концентрацией катализатора, если время – меньше, то соответственно следует уменьшить концентрацию катализатора.
5) Приготавливают поочередно серию стандартных растворов в мерных колбах вместимостью 50 см3, согласно таблице 2. Объем стандартного раствора катализатора следует взять по результатам таблицы 1. Растворы приготавливают поочередно, после добавления катализатора включают секундомер, затем доводят объем колбы дистиллированной водой до метки.
6) Заполняют кювету сначала первым стандартным раствором и проводят измерение абсорбции через каждую минуту относительно дистиллированной воды на выбранном светофильтре. Затем приготавливают и фотометрируют второй раствор, третий и т.д., результаты заносят в таблицу3.
|
|
Таблица 2 - Состав стандартных растворов
| № колбы | Объем реактива, см3 | |||
| FeCl3 | NH4СNS | Na2 S2 О3 | СuSO4 | |
7) Получают анализируемый раствор тиосульфата натрия у лаборанта в мерную колбу вместимостью 50 см3 , добавляют те же реактивы, что и при приготовлении стандартных растворов, затем катализатор (одновременно включают секундомер), доводят дистиллированной водой до метки. Затем заполняют кювету анализируемым раствором и измеряют абсорбцию через каждую минуту (см. пункт 5). Результаты заносят в таблицу 3.
8) По окончании работы, выключают фотоколориметр, моют посуду, приводят рабочее место в порядок.
Расчет результатов анализа
1) Расчет концентрации приготовленных стандартных растворов тиосульфат-ионов

где Сисх.ст. р-ра. – концентрация исходного стандартного раствора тиосульфат-иона, моль/дм3; Сст. – концентрация, приготовленного раствора в колбе, моль/дм3; Vисх.ст.р-ра. – объем исходного стандартного раствора, дм3; Vк – объем колбы, дм3.
2) Построение графиков в координатах -lgA – время (рисунок 1). Графики строятся по результатам эксперимента (таблица3).
Таблица 3 – Результаты эксперимента
| Стандартные растворы, моль/дм3 | Анализируемый раствор | |||||||||||||
| С 1 | С 2 | С 3 | С 4 | |||||||||||
| t, мин | А | -lg A | t, мин | А | -lg A | t, мин | А | -lg A | t, мин | А | -lg A | t, мин | А | -lg A |
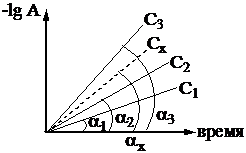
Рисунок 1 – Кинетические кривые для определения концентрации
По методу тангенсов
По графикам определяют тангенсы угла наклона прямолинейных зависимостей (tg a) для стандартных растворов и анализируемого раствора.
3) Определение концентрации тиосульфат-иона в анализируемом растворе. Строят калибровочный график в координатах (tg a) – концентрация стандартных растворов (рисунок 2) и по нему определяют концентрацию тиосульфат-иона в анализируемом растворе.

Рисунок 2 – Градуировочный график для определения концентрации
Анализируемого вещества
Достоверность результата проверяют у преподавателя или лаборанта, оформляют отчет по лабораторной работе.
Вопросы к отчету по лабораторной работе
1 Кинетические методы анализа. Индикаторная реакция, индикаторное вещество.
2 Требования к реакциям в кинетических методах анализа. Зависимость скорости реакции от различных параметров.
3 Методы расчета концентраций: метод тангенсов, метод фиксированного времени, метод фиксированной концентрации.
4 Методика определения тиосульфат-ионов на КФК-2. Подбор оптимальной концентрации катализатора (CuSO4).
5 Блок-схема фотоколориметра КФК-2, выбор светофильтра.