ЛР 21 Кулонометрические установки
Цель: ознакомиться с возможностями проведения анализа образцов природных вод и других растворов на электрохимических установках.
Кулонометрические установки и техника их использования
Кулонометрические методы анализа основаны на измерении количества электричества, израсходованного на электролиз определяемого вещества при постоянном потенциале. Эти измерения проводят на кулонометрической установке (рис. 1).
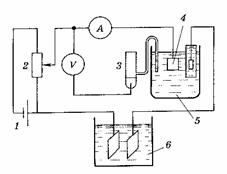
| Рис. 1. Схема установки для потенциостатической кулонометрии. 1– аккумуляторная батарея 2 – реостат 3 – электрод сравнения (каломельный или хлорсеребряный) 4 – рабочий электрод 5 – кулонометрическая ячейка 6 – кулономер 7 – вспомогательный электрод |
Основой метода кулонометрического анализа является закон Фарадея, устанавливающий связь между количеством вещества, выделившегося на электроде (m) и количеством израсходованного при этом электричества (Q).
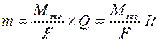 (1)
(1)
где I – сила тока, А;
F – число Фарадея, равное 96485 Кл/моль;
t – продолжительность прохождения силы тока, мин.;
M экв — молярная масса химического эквивалента вещества (иона)*, г/моль экв. (или в формуле м. б. представлена Э – эквивалентная масса электролита, г/моль);
Q – количество электричества, израсходованного на электрохимическое превращение вещества.
Для получения постоянного тока обычно используют выпрямитель переменного тока или батарею аккумуляторов 1 (рис. 1). Скользящий контакт 2 позволяет регулировать подаваемое напряжение, которое измеряют вольтметром. Сила тока контролируется амперметром. При выделении металлов катод 5 обычно изготавливают из платиновой сетки, анод 4 – из платиновой спирали или пластинки. При выделении оксидов знаки электродов меняются, платиновая сетка становится анодом, а спираль – катодом. Раствор перемешивают механической или магнитной мешалкой 3.
При проведении кулонометрического титрования пользуются лабораторным титратором. Он изготавливается в двух модификациях: с серебряными электродами (предназначены для определения хлорид-ионов) и с платиновыми (для проведения кулонометрических титрований). Для индикации кулонометрического титрования используют амперометрический метод.
В процессе титрования при прохождении тока через генераторный электрод происходит образование титранта. При появлении в растворе свободного титранта (после достижения конечной точки титрования) наступает либо поляризация, либо деполяризация индикаторных электродов, в результате чего в цепи последних резко изменяется ток. Это вызывает срабатывание релейной системы, которая разрывает цепь питания генераторных электродов и останавливает электросекундомер. Процесс титрования прекращается. Снимают показания счетчика времени и рассчитывают массу определяемого вещества, используя закон Фарадея.
Косвенная кулонометрия является одним из наиболее универсальных методов, широко используемых для определения органических веществ в различных объектах.
Кондуктометры: возможность использования в аналитических целях
Аналитическим сигналом кондуктометра является электрическая проводимость растворов электролитов. Кондуктометрическая ячейка состоит из двух платиновых электродов впаянных в стеклянный сосуд.
Кондуктометрический метод основан на измерении электропроводности растворов электролитов.
Электрическая проводимость раствора электролита является результатом диссоциации растворенного вещества и миграции ионов под действием внешнего источника напряжения. Электропроводность раствора обратно пропорциональна его сопротивлению, она измеряется в сименсах (См), причем 1 См = 1 Ом-1.
Электропроводящие свойства растворов можно охарактеризовать удельной электропроводностью % (Ом-1 см-1 или Ом-1м-1) и эквивалентной электропроводностью А (Ом-1см2 моль-1).
Удельная электропроводность (%) – электропроводность 1 см3 раствора, помещенного между электродами площадью 1 см2, расположенными на расстоянии 1 см.
Эквивалентная электропроводность (А,) – электропроводность раствора, содержащего 1 моль-эквивалент электролита, измеренная при расстоянии между электродами 1 см.
Удельная и эквивалентная электропроводность электролита связаны соотношением
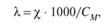
где См — молярная концентрация эквивалента вещества, моль/л.
Величина электропроводности зависит от концентрации ионов, их природы, заряда, температуры раствора, его вязкости и др.
Кондуктометрический метод может быть реализован в виде прямой кондуктометрии или кондуктометрии или кондуктометрического титрования.
Метод прямой кондуктометрии основан на том, что в области разбавленных и умеренно концентрированных растворов электрическая проводимость растет с увеличением концентрации электролита. В практической работе обычно используют заранее построенную градуировочную кривую зависимости электрической проводимости раствора от концентрации тех или иных электролитов.
Косвенные методы (кондуктометрическое титрование), позволяют с высокой селективностью оценивать содержание веществ, которые реагируют со специально подобранными реагентами, а регистрируемое изменение электропроводности вызывается только присутствием соответствующих продуктов реакции. При этом находят точку эквивалентности графическим методом с помощью кривой проводимости – объем титранта.
В настоящее время применяются лабораторные кондуктометры ЭКА-2, КЭЛ-1М, ЭКОТЕСТ-КМ с автоматическим переключением диапазонов.
Кондуктометр КЭЛ-1М – это электродный лабораторный кондуктометр предназначенный для измерения электрической проводимости водных и неводных растворов кислот, щелочей и солей.
Прибор состоит из трех блоков: преобразователя первичного, преобразователя температурного и преобразователя измерительного. Измерительный преобразователь представлен на рис. 3. Он соединен специальным кабелем с первичным преобразователем.
Кондуктометрическое титрование выполняется с помощью установки, в комплект которой входит ячейка с жестко закрепленными в ней двумя электродами (обычно платиновыми), бюретка для раствора титранта, магнитная мешалка и прибор для измерения электрической проводимости или сопротивления раствора. Кондуктометр КЭЛ-1М может быть использован в кондуктометрическом титровании, если его снабдить дополнительным узлом – калибровочной приставкой.
Ход работы:
1. Опишите кулонометрическую установку.
2. Опишите устройство кондуктометра.
3. Сделайте выводы.
Контрольные вопросы:
1. Что является аналитическим сигналом в кулонометрии? Какая характеристика раствора определяется?
2. Что является аналитическим сигналом в кондуктометрическом методе? Какая характеристика раствора определяется?