Основные утверждения МКТ
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Пдтверждение МКТ:
 1. экспериментальное
1. экспериментальное
- механическое дробление вещества; растворение вещества в воде; сжатие и расширение газов; испарение; деформация тел; диффузия; опыт Бригмана: в сосуд заливается масло, сверху на масло давит поршень, при давлении 10 000 атм масло начинает просачиваться сквозь стенки стального сосуда;
- диффузия; броуновское движение частиц в жидкости под ударами молекул;
- плохая сжимаемость твердых и жидких тел; значительные усилия для разрыва твердых тел; слияние капель жидкости;
2. прямое
- фотографирование, определение размеров частиц.
Броуновское движение
Броуновское движение - это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
- открыто английским ботаником Р. Броуном в 1827 г.
- дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
- экспериментально подтверждено французским физиком Ж. Перреном.
Масса и размеры молекул
Размеры частиц
Диаметр любого атома составляет около  см.
см.

Число молекул в веществе

где V - объем вещества, Vo - объем одной молекулы
Масса одной молекулы

где m - масса вещества,
N - число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Условно принято считать за 1 а.е.м.:

Относительная молекулярная масса вещества
Для удобства расчетов вводится величина - относительная молекулярная масса вещества.
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.
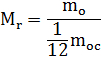
где числитель - это масса молекулы, а знаменатель - 1/12 массы атома углерода
 - это величина безразмерная, т.е. не имеет единиц измерения
- это величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса химического элемента
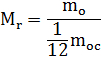
где числитель - это масса атома, а знаменатель - 1/12 массы атома углерода
 - величина безразмерная, т.е. не имеет единиц измерения
- величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Другой способ определения относительной молекулярной массы вещества
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
Относительную атомную массу любого химического элемента берем из таблицы Менделеева!
Количество вещества
Количество вещества (ν) определяет относительное число молекул в теле.

где N - число молекул в теле, а Na - постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль - это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.
Запомни!
В 1 моле любого вещества содержится одинаковое число атомов или молекул!
Но!
Одинаковые количества вещества для разных веществ имеют разную массу!
Постоянная Авогадро
Число атомов в 1 моле любого вещества называют числом Авогадро или постоянной Авогадро:

Молярная масса
Молярная масса (M) - это масса вещества, взятого в одном моле, или иначе - это масса одного моля вещества.

где
 - масса молекулы
- масса молекулы
 - постоянная Авогадро
- постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.
Формулы для решения задач
Эти формулы получаются в результате подстановки вышерассмотренных формул.
Масса любого количества вещества

и формула для 7 класса
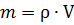
(плотность х объем)
Количество вещества
