1 Буровые растворы как дисперсные системы.
2 Материалы для приготовления и регулирования свойств буровых растворов.
3 Основы химии полидисперсных гетерогенных растворов.
1. Буровые растворы как дисперсные системы
Ионный обмен в глинистых и цементных суспензиях. Физико-химические свойства глинистых и цементных суспензий во многом определяются протекающими в них ионно-обменными и адсорбционными процессами.
Первая причина катионного обмена глинистых минера лов - нарушение связей их краев, что обусловливает возникновение некомпенсированных зарядов, которые уравновешиваются адсорбированными катионами. По мере
диспергирования глинистых частиц увеличивается емкость обмена.
Вторая причина, которая обусловливает катионный об мен, - замещение внутри кристаллической решетки кремния алюминием, а алюминия - магнием или другим ионом низшей валентности. Это приводит к возникновению заряда в структурной ячейке, который и уравновешивается зарядом адсорбированного обменного катиона (например, монтмориллонит)
Третья причина катионного обмена - замещение водорода наружного гидроксила на соответствующий катион. Некоторые гидроксильные группы
обнажаются вокруг обломанных краев при нарушении связи. Эта причина
ионного обмена характерна для каолинита и галуазита в связи с наличием слоев гидроксилов на одной стороне базальной плоскости спайности. Малая емкость обмена каолинита связана с жесткостью его кристаллической решетки, что не позволяет катионам (и воде) проникать внутрь последней и в межслоевое пространство.
Обменная способность катионов тем выше, чем больше их валентность, а в пределах ионов одной валентности она тем выше, чем больше атомный вес. Таким образом, по способности вхождения в поглощающий комплекс катионы можно расположить в следующий ряд:
Al3+ > Са2+ > Mg2+ > K+ > NH4+ > Na+ > Li+.
Это объясняется тем, что с увеличением объема иона возрастает его
поляризуемость, которая позволяет иону ближе подойти к электрически заряженной поверхности глины, а с увеличением радиуса иона уменьшается степень его гидратации, что способствует вхождению его в адсорбционный слой поглощающего комплекса.
Установлен ряд поглощения катионов из водных растворов:
Pb2+ > Cu2+ > Ca2+ > Ba2+ > Mg2+ > Кд2+.
В области буровых растворов изучение ионного обмена имеет важное значение для выяснения специфического влияния обменных ионов на вязкость, тиксотропию, стабильность и другие свойства. Примером может служить практическое использование некоторых солей (например, Na2CO3, фосфатов, СаС12 и др.) для регулирования рН, снижения растворимости ионов-коагуляторов,
изменения гидрофильности глинистых частиц и т.д.
Коллоидные растворы высокомолекулярных соединений. Вследствие больших размеров молекул растворы высокомолекулярных веществ очень медленно диффундируют; макромолекулы неспособны проникать через полупроницаемые мембраны. Эти свойства наиболее характерны для типичных коллоидных систем;
поэтому растворы высокомолекулярных веществ были отнесены к коллоидным системам.
|
|
 Примеры: КМЦ, ГЭЦ, полиакрилат, РНР
Примеры: КМЦ, ГЭЦ, полиакрилат, РНР
Б

 Примеры: крахмал, ХС Полимер, КМК
Примеры: крахмал, ХС Полимер, КМК
В
Пример: сшитый КС полиме
Рис. 16. Схемы расположения элементарных звеньев полимеров. А - линейная структура, Б - разветвленная, В – сшитая
Молекулярная масса большинства полимеров в среднем составляет от 50 000 до 200 000. Наибольшая молекулярная масса у биополимеров (XCD), от 2 000 000 до 5 000 000.
Полимерными называются водные растворы высокомолекулярных веществ (ВМВ), молекулы которых построены путем многократного повторения одного и того же звена
 - мономера. Например, мономер ПАА: - CH2 - CH - CONH2n. Если в молекуле чередуются разные мономеры, то такое ВМВ называется сополимером.
- мономера. Например, мономер ПАА: - CH2 - CH - CONH2n. Если в молекуле чередуются разные мономеры, то такое ВМВ называется сополимером.
 псевдопластичные свойства, благодаря которым полимерные растворы обладают хорошей очистной, несущей (транспортирующей) и удерживающей способностью. Это обеспечивается тем, что при малых скоростях сдвига, имеющих место в затрубном пространстве скважин, вязкость полимерных растворов во много раз превышает вязкость воды, а при высоких скоростях сдвига, характерных для промывочных каналов долот, их вязкость близка к вязкости воды.
псевдопластичные свойства, благодаря которым полимерные растворы обладают хорошей очистной, несущей (транспортирующей) и удерживающей способностью. Это обеспечивается тем, что при малых скоростях сдвига, имеющих место в затрубном пространстве скважин, вязкость полимерных растворов во много раз превышает вязкость воды, а при высоких скоростях сдвига, характерных для промывочных каналов долот, их вязкость близка к вязкости воды.
 способность создавать на стенках скважин полимерную пленку, препятствующую проникновению фильтрата в поры горных пород. Это обусловлено проявлением полимерными растворами полиэлектролитных свойств, обеспечивающих, благодаря наличию
способность создавать на стенках скважин полимерную пленку, препятствующую проникновению фильтрата в поры горных пород. Это обусловлено проявлением полимерными растворами полиэлектролитных свойств, обеспечивающих, благодаря наличию
зарядов, адсорбцию молекул полимера на стенках скважин, а также на частицах
выбуренных пород. Последнее, т.е. адсорбция молекул полимера на частицах выбуренных пород, обеспечивает улучшение очистки бурового раствора от шлама вследствие процесса флокуляции.
Полимерные реагенты получают или химической переработкой (модифицированием) природных высокомолекулярных соединений или их синтезом из низкомолекулярных веществ. Известны два синтетических метода:
полимеризация - реакция соединения молекул, протекающая без изменения элементарного состава реагирующих веществ и выделения побочных продуктов; поликонденсация - реакция соединения молекул, сопровождающаяся отщеплением простейших веществ (воды, спирта, аммиака, хлористого водорода и др.). В отличие от продуктов полимеризации элементарный состав конденсационного
полимера не совпадает с элементарным составом исходных веществ. Синтез полимеров из низкомолекулярных веществ возможен в том случае, если их
молекулы могут взаимодействовать вследствие активации с двумя другими молекулами, т. е. если исходное вещество по крайней мере бифункционально. Вещества являются функциональными, если в их молекулах есть двойные или тройные связи и содержатся функциональные группы
В зависимости от функциональности элементарных звеньев могут образоваться линейны, разветвленные и сетчатые полимеры (рис. 16).
У линейных полимеров для увеличения длины молекулярной цепи используют только две валентности, остальные валентности насыщаются водородом или
другими заместителями. В том случае, когда третья валентность или обе оставшиеся валентности атома углерода служат для дальнейшего роста макромолекулярной цепи того же состава, что и основная цепь, говорят о разветвленных полимерах, если число разветвлений таково, что образуется еще растворимый полимер. Сетчатыми (пространственными) полимерами называют
такие вещества, у которых отдельные линейные или разветвленные макромолекулы не могут переходить в раствор. Все типы органических соединений, как видно из таблицы, могут быть использованы в бурении: растворимые высоко- и низкомолекулярные соединения - для химической
обработки промывочных жидкостей; сетчатые (пространственные) полимеры - для тампонирования скважин при изоляционных работах и креплении.
Особенностью органических полимеров является гибкостьихмолекул - способность полимерных цепей изменять свою форму. Она обусловлена тем, что макромолекулы таких полимеров представляют собой цепи, составленные из большого числа отдельных элементов, каждый из которых
способен совершать тепловое движение и взаимодействовать с другими элементами, удаленными по цепи. Изменение формы макромолекул в результате внутримолекулярного теплового
движения или под действием внешнего поля без разрушения химических связей приводит к конформационным превращениям. Число возможных конформаций зависит от
|
цепи полимера при фиксированных валентных углах
длины цепи и ее гибкости (рис. 17)
Вращение цепей происходит при неизменных валентных углах молекулы, атомы которой соединены
одинарной связью, и приводит к образованию структур нерегулярной формы. Эти структурные формы не существуют в постоянном виде, а непрерывно переходят одна в другую без разрыва химических связей. В ре зультате таких изменений макромолекулы могут либо свертываться, образуя глобулы и клубки, либо выпрямляться. Гибкость полимерной цепи увеличивается с ростом температуры и с уменьшением числа полярных групп. Кроме того, большое влияние на гибкость макромолекулы оказывают наличие боковых цепей (у разветвленных молекул она ниже), воздействие соседних молекул полимера и растворителя.
Обычно в состав органических соединений, используемых для химической обработки промывочных жидкостей, входит большое число полярных групп (– ОН, – СООН, = СО, – СОН, – NН2 –CONH2, –SO3H и др.), которые могут оказывать сильное упорядочивающее воздействие на молекулы воды. По характеристике функциональных групп они подразделяются на неионогенные (группы –ОН, - СО, –СОН, - CONH2) и ионогенные мицеллярные электролиты, или полиэлектролиты. Последние могут быть анионными (содержат функциональные группы основного типа, например –СООН и SO2OH), катионными (содержат кислотные группы, например - NH2 и = NH) и катионно-анионными (полиамофолиты, содержащие кислотные и основные группы). Нередко в состав высокомолекулярных соединений, особенно получаемых путем модифицирования природных веществ, одновременно могут входить неионогенные, анионные и катионные полярные группы.
Растворы полимеров, как и мицеллярные растворы ПАВ, относятся к лиофильным дисперсным системам. Они являются термодинамически обратимыми и агрегативно устойчивыми системами, образующимися самопроизвольно путем диспергирования.
Значительными достижениями последних лет следует считать разработка промывочных жидкостей на основе биополимеров. Биополимеры - это природные или биосинтетические (продуцируемые микробами и штаммами) высокомолекулярные соединения, являющиеся основой всех живых организмов и
растений. Наиболее распространенным биополимером является целлюлоза и ее производные, относящиеся к полисахаридам и составляющие основную часть
клеточных стенок растений. По сравнению с биосинтетическими полимерами природные биополимеры относительно недороги и доступны. Отработанные буровые биополимерные промывочные жидкости не требуют специализированной утилизации, так как, подвергаясь биологическому разложению при контакте с микрофлорой почв, обогащают ее.
Важнейшие технологические свойства промывочных жидкостей:
плотность, реологические и фильтрационные характеристики, смазочно-
охлаждающая способность, активность и инертность по отношению к разбуриваемым породам - регулируются комплексом физико-химических воздействий на отдельные фазы или дисперсную систему в целом в процессе их получения и использования. Наибольшее распространение в этом комплексе получили: обработка химическими соединениями неорганического и органического состава, разбавление и концентрирование, механохимическая
активация и перемешивание при тепловом воздействии или без него. Лабораторные и опытно-промышленные испытания проходят такие методы воздействия на промывочные жидкости, как «омагничивание», ультразвуковая и электрическая обработка. В значительной степени технологические свойства промывочных жидкостей определяются их устойчивостью, т.е. сохранением во времени основных параметров дисперсной системы: дисперсности (удельной поверхности) и равномерного распределения дисперсной фазы в дисперсионной среде (одинаковая плотность по объему). Знание основных факторов устойчивости дисперсных систем и причин, ведущих к ее нарушению, позволяют обоснованно управлять свойствами промывочных жидкостей при бурении.
Лиофильные дисперсные системы. Особый интерес представляют коллоидные растворы ПАВ, способные к самопроизвольному мицеллообразованию в растворах - образованию лиофильных дисперсных систем выше некоторой определенной концентрации ПАВ. Концентрация, при которой начинается процесс мицеллообразования, называется критической концентрацией мицеллообразования (ККМ). При достижении концентрации ПАВ в растворе несколько большей ККМ начинают формироваться сферические мицеллы.
Мицелла - это наименьшее количество глинистого вещества, способного к самостоятельному существованию (13).
Дисперсная фаза в виде мицеллы - глинистой частицы, покрытой гидратной оболочкой. Дисперсионная среда - межмицеллярная жидкость (свободная вода)
 Внутренняя часть мицеллы называется ядром. На поверхности ядра концентрируются гидроксил - ионы ОН-,
Внутренняя часть мицеллы называется ядром. На поверхности ядра концентрируются гидроксил - ионы ОН-,
сообщающие ему отрицательный заряд. Эти ионы прочно связаны с ядром и образуют внутреннюю обкладку двойного электрического слоя (ДЭС). Вокруг нее располагается слой также
прочно притянутых к ядру, но положительно заряженных ионов Н+. Часть мицеллы, включающая в себя ядро с двумя слоями неподвижных ионов, называется гранулой. Вокруг гранулы
Рис. 13. Схема строения мицеллы
располагается третий слой также положительно заряженных ионов, но имеющих очень слабую связь с ядром. Слой подвижных ионов называется диффузным.
Слой отрицательно заряженных ионов и слои положительно заряженных ионов образуют двойной электрический слой (ДЭС).
Между диффузным и неподвижным слоями катионов существует динамическое равновесие: одни катионы переходят из неподвижного слоя в диффузный, другие - возвращаются из диффузного в неподвижный.
В воде простейшие сферические мицеллы выглядят так, как показано на рис.
14. Внутренняя часть мицелл состоит из переплетающихся углеводородных радикалов, полярные группы молекул ПАВ обращены в водную фазу. Число молекул в мицелле быстро растет в пределах узкого интервала концентраций; а при
дальнейшем увеличении концентрации ПАВ практически не меняется, а увеличивается только число самих мицелл. Сферические мицеллы могут содержать
от 20 до 100 (и более) молекул ПАВ. При дальнейшем росте концентрации ПАВ сферические мицеллы начинают взаимодействовать между собой, что приводит к их деформации.
Глинистые растворы относятся к гидрофильным системам. Глины, сравнительно легко диспергируясь, энергично взаимодействуют с водой. Элементарные частицы глины за счет сил молекулярного сцепления покрываются адсорбционной пленкой воды.
Гидрофильность глинистых минералов оценивается различными формами связанной воды. По величине и природе энергии связи П.А. Ребиндер различает четыре формы связи воды с дисперсными материалами:
s химически связанная вода;
s адсорбционно связанная вода;
s капиллярно связанная вода;
s свободная вода, механически захваченная дисперсной структурой и заполняющая поровое пространство.
Количествосвязаннойводы,отнесенноекединицемассыглины,характеризуетразмерыэффективнойудельнойповерхностиигидрофильностьглины.Сувеличениемудельнойповерхностиглинистыхминераловколичествосвязаннойводырастет.
Глинистые буровые и цементные растворы могут коагулировать под влиянием различных факторов: добавления электролитов, изменения температуры, изменения содержания твердой фазы и т.д. Из них наибольшее значение имеет коагуляция электролитами.
Материалы для приготовления и регулирования свойств буровых растворов. Глины. Из общего объема осадочных пород на долю глинистых приходится около 70%. Глинистые породы составляют значительную часть разреза бурящихся скважин, но даже в тех районах, где мощность глинистых пород невелика, они оказывают большое влияние на условия бурения. К их числу относятся глины, лѐссы, суглинки, аргиллиты и др.
В глинах содержатся в различных количествах окислы железа (например Fе2О3), щелочных металлов (Nа2О, К2О), щелочноземельных металлов (СаО, МgО). Присутствие в глинах окислов во многом определяет их свойства. Одним из определяющих признаков является отношение SiO2:R2О3 (где R–А1, Fе). Это отношение колеблется для минералов монтмориллонитовой группы от 4 до 7, каолинитовой - от 2 до 3, гидрослюдистой - от 3 до 4, палыгорскитовой - от 2,1 до
2,5.
В глинистых минералах обменными катионами являются Са2+, Мg2+, К+, Nа+, Н+, NН4+. В природных глинах к основным обменным катионам относится Na и Ca, поэтому глины получили название соответственно Na или Са. Независимо от состава обменного комплекса все глины в той или иной степени являются
гидрофильными.
При замачивании глины водой глинистые частицы покрываются гидратной оболочкой. Молекулы воды, проникая между кристаллами, раздвигают их, и глина набухает. Характер набухания зависит от типа глины. Чем меньше поливалентных катионов содержится в обменном комплексе минерала, тем сильнее разобщаются слои и больше набухает глина. Так, натриевые бентонитовые глины, имея подвижную кристаллическую решетку, могут при замачивании увеличиваться в объеме в 8 - 10 раз и легко распускаться в воде. Каолиновые глины набухают и распускаются в воде плохо. Растворы, приготовленные из них, довольно неустойчивы. Гидрослюдистые глины и палыгорскит занимают промежуточное положение.
Глинистые минералы по химическому составу представляют собой водные (содержащие кристаллизационную воду) алюмосиликаты. Суммарное содержание глинозема (Al2O3), кремнезема (SiO2) и воды достигает в глинах 75 - 90 %. Остальное приходится на долю других элементов периодической системы, среди которых явно преобладают Na+, K+, Ca2+, Mg2+ и Fe2+. На основании различий в химическом составе, строении кристаллической решетки и свойствах глинистые минералы объединяют в четыре основные группы, получившие название по ведущему минералу:
|
 группа монтмориллонита (монтмориллонит, бейделлит, сапонит, гекторит, соконит, нонтронит и др.);
группа монтмориллонита (монтмориллонит, бейделлит, сапонит, гекторит, соконит, нонтронит и др.);
группа гидрослюды (гидромусковит, гидробиотит); группа каолинита (каолинит, диккит, накрит, галлуазит); группа палыгорскита.
Монтмориллонитовые глины среди специалистов по бурению скважин принято
называть бентонитовыми или просто бентонитом.
Глины, состоящие из нескольких глинистых минералов без явного преобладания какого-либо из них, называются полиминеральными (каолинит - гидрослюдистые, монтмориллонит - каолинит-гидрослюдистые и др.).
Кристаллическая решетка большинства глинистых минералов состоит из двух структурных элементов: слоев алюмокислородных октаэдров (АКО) (рис. 1) и слоев кремнекислородных тетраэдров (ККТ) (рис. 2).
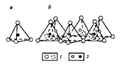
Рис.1. Схематическое изображение октаэ дра (t) и
октаэ дричес кой сетки структуры: 1
- гидроксилы; 2 - алюминий, магний и
т.д

Р ис.2. Схематическоеизобр ажение кр ем некислор о дно го тетр аэ др а (1) и сетки
кр ем некислор о дных тетраэ дро в, р аспо ло женных по гексагональному закону:
1 - атомы кислорода; 2 - атомы кремния
Эти слои, чередуясь, образуют пакеты. По числу
тетраэдрическ их слоев в
пакете различают следующие
два типа кристаллических решеток глинистых минералов:
 двухслойные, состоящие из соединения слоев кремнекислородных тетраэдров и алюмокислородных октаэдров в соотношении 1:1 (каолинит);
двухслойные, состоящие из соединения слоев кремнекислородных тетраэдров и алюмокислородных октаэдров в соотношении 1:1 (каолинит);
 трехслойные, представленные теми же элементами в соотношении 2:1 (монтмориллонит, гидрослюда).
трехслойные, представленные теми же элементами в соотношении 2:1 (монтмориллонит, гидрослюда).
Монтмориллонит и другие минералы этой группы состоят из двух тетраэдрических сеток, между которыми располагается октаэдрическая сетка, т.е. имеют структуру типа 2: 1 (рис. 3). Все вершины тетраэдров обращены к центру структурного слоя и совместно с гидроксидами октаэдрической сетки обр азуют общий слой, в котором в вершинах, общих для обеих сеток, располагаются
Палыгорскит относится к глинистым минералам ленточно–слоистой структуры, но его кристаллическую решетку также можно отнести ко второму типу, т.е. к трехслойной.
Монтмориллонит состоит из октаэдрического алюмокислородного слоя,
заключенного между тетраэдрическими кремнекислородными слоями, вершины которых повернуты к внутреннему слою. Верхние и нижние плоскости элементарных пакетов монтмориллонита покрыты атомами кислорода, поэтому связь между пакетами слабая (действуют лишь вандерваальсовые или межмолекулярные силы).
В этой связи молекулы воды или других полярных жидкостей могут свободно проникать между пакетами монтмориллонита и раздвигать их.
Между элементарными пакетами монтмориллонита связь слабая, поскольку базальные поверхности покрыты атомами кислорода и между ними действуют лишь
вандерваальсовы силы; пакеты гидрослюды фиксируются между собой катионами К+, входящими в межпакетное пространство, а пакеты каолинита связаны между собой довольно прочной водородной связью типа О-Н.
Двухвалентные катионы обеспечивают более сильное притяжение между пакетами по сравнению с одновалентными, в связи с чем Са-бентонит хуже диспергируется и набухает, чем Na-бентонит.
Располагающиеся в межпакетном пространстве катионы Na+, K+, Ca2+ и Mg2+, в водном растворе способны к эквивалентному обратимому обмену с другими находящимися в растворе катионами, поэтому их называют обменными.
 Способность глинистых минералов поглощать ионы из окружающей среды и выделять эквивалентное количество других ионов, находящихся в данном минерале в обменном состоянии, называется обменной способностью глин. Показателем
Способность глинистых минералов поглощать ионы из окружающей среды и выделять эквивалентное количество других ионов, находящихся в данном минерале в обменном состоянии, называется обменной способностью глин. Показателем
обменной способности глин является емкость поглощения, которая характеризуется количеством обменных катионов в молях, содержащихся в 100 г сухой глины.
Моль - это количество вещества, содержащее столько же структурных единиц данного вещества (молекул, атомов, ионов), сколько атомов в 12 г углерода (6,022·1023 атомов).
Общая величина обменного комплекса монтмориллонита составляет 80*10–3 -
150*10–3 моль/100 г, т.е. в 100 г сухой глины содержится 4,8*1022 - 9*1022
обменных катионов. 80 % обменных катионов располагаются в межпакетном пространстве, а  20 % - на механически обломанных краях (ребрах) кристаллов монтмориллонита, которые имеют форму тонких плоских пластинок, напоминающих чешуйки слюды.
20 % - на механически обломанных краях (ребрах) кристаллов монтмориллонита, которые имеют форму тонких плоских пластинок, напоминающих чешуйки слюды.
Удельная поверхность монтмориллонита составляет 450 - 900 м2/г.
Характерной особенностью структуры монтмориллонита является то, что кислородная поверхность одного слоя контактирует с аналогичной кислородной поверхностью соседнего слоя, вследствие чего связь между слоями слабая.
Поэтому молекулы воды и других, полярных жидкостей могут свободно проникать между структурными слоями монтмориллонита и раздвигать их, снижая тем самым и без того крайне слабое молекулярное взаимодействие между ними.
Гидрослюда. Кристаллическая решетка гидрослюды подобна монтмориллониту, но имеет большее число изоморфных замещений. Так, у гидромусковита октаэдрические позиции в основном заполнены Al3+, а у гидробиотита могут быть замещены Fe2+ или Mg2+. Кроме того, у того и другого минералов в тетраэдрическом слое до 1/6 всех атомов Si4+ изоморфно замещены Al3+. Возникающий при этом отрицательный заряд компенсируется катионами К+, входящими в межпакетное пространство гидрослюд.
 Близкое расположение заряда, который локализован в тетраэдрическом слое, к поверхности пакета приводит к прочному ионному взаимодействию смежных пакетов с катионами К+ и молекулы воды уже не могут проникать в межпакетное пространство.
Близкое расположение заряда, который локализован в тетраэдрическом слое, к поверхности пакета приводит к прочному ионному взаимодействию смежных пакетов с катионами К+ и молекулы воды уже не могут проникать в межпакетное пространство.
|

10–3моль/100г. Гидратация слюд и некоторое увеличение их объема, которое
значительно меньше, чем у монтмориллонита, происходит в результате ионообменных реакций на внешних механически разорванных гранях. Удельная поверхность гидрослюд составляет 400 - 500 м2/г
Каолинит имеет двухслойную кристаллическую решетку без зарядов на базальных поверхностях, что объясняется отсутствием изоморфных замещений.
В алюмокислородном слое значительная часть атомов кислорода замещена группами ОН–.
Атомы кислорода и гидроксил ионы смежных соприкасающихся пакетов находятся друг против друга и по всей площади довольно прочно связаны водородной связью типа О–Н, которая препятствует внутрикристаллическому разбуханию решетки.
В связи с тем, что молекулы воды и катионы не могут проникать в межпакетное пространство, каолинит трудно диспергируется, имеет малую емкость обмена 3 
|
По форме частицы каолинита представляют собой несколько вытянутые
шестиугольные пластинки, удельная поверхность каолинита оставляет всего 10 - 20
м2/г.
Палыгорскит. Кристаллическую решетку палыгорскита тоже можно считать трехслойной. Однако кремнекислородные тетраэдры в наружных слоях расположены необычно: в слое чередуются тетраэдры, обращенные вершинами внутрь к среднему октаэдрическому слою, и наружу.
Благодаря такому расположению структурных элементов кристаллы палыгорскита имеют не пластинчатую, а игольчатую форму.
Когда палыгорскит помещают в воду, он не набухает, как бентонит, и его приходится диспергировать энергичным перемешиванием.
|
|
Главной особенностью палыгорскита («солт-джел» - солоноватая глина) является способность диспергироваться и образовывать структурированные суспензии в соленасыщенной воде. При этом получение устойчивых
структурированных суспензий достигается благодаря неупорядоченности структуры, которая образуется путем механического зацепления
Палыгорскитовая глина представляет собой смесь минералов палыгорскита и монтмориллонита. Она отличается волокнистым строением, высокой
гидрофильностью, обладает способностью одинаково хорошо набухать как в пресной, так и в соленой воде независимо от концентрации NaCl. Солестойкость
палыгорскитовых глин объясняется высоким содержанием силикатов, окиси Mg и незначительным присутствием ионов K и Na. Палыгорскитовые глины в растворе NaCl 1 - 3%-ной концентрации «связывают» больше воды, чем в пресной воде. Водоотдача палыгорскитовой суспензии достаточно велика, что обусловлено рыхлым строением их фильтрационных корок, но при засолении в отличие от других глин - уже не возрастает. Для палыгорскитовых глин характерны замедленные: пептизация и размокание.
В буровой практике не применяются мономинеральные глины, однако исследование таких систем позволяет более глубоко и научно обоснованно подходить к подбору сырья для создания буровых растворов с заданными свойствами.
Эмульсии, системы, в которых дисперсная фаза и дисперсионная среда представляют собой несмешивающиеся жидкости, могут быть использованы в
качестве буровых растворов или для приготовления более сложных систем. В эмульсии одна жидкость должна быть полярна, а другая неполярна. Жидкость, которая непрерывна во всем объеме, является дисперсионной средой.
Вода и масло могут образовывать эмульсии двух типов. Первый тип: вода - дисперсионная среда, а масло - дисперсная фаза, раздробленная в воде в виде отдельных капелек. Коалесценция, как и коагуляция, протекает самопроизвольно,
так как она сопровождается уменьшением запаса свободной энергии. В отличие от коагуляции, коалесценция необратима.
 Форма капель в концентрированных эмульсиях искажается, из шариков они превращаются в многогранники (рис. 3).
Форма капель в концентрированных эмульсиях искажается, из шариков они превращаются в многогранники (рис. 3).
Такое искажение формы связано с тем, что многогранники могут быть плотнее упакованы, чем шарики. Если принять, что все капельки одинакового

 Рис. 3. Форма капель в концентрированных эмульсиях
Рис. 3. Форма капель в концентрированных эмульсиях
размера и строго шарообразны, то они в плотно упакованном состоянии занимают 74% общего объема системы, а остающиеся 26% объема приходятся на промежутки между
капельками, т.е. на дисперсионную среду. Практически же удается получить гораздо
более концентрированные эмульсии как за счет деформации, так и за счет различия в
Рис.4. Ячеисто-пленочная структура пены
размерах капель (полидисперсности эмульсии). Пенами называют высококонцентрированные связные дисперсные системы, в которых дисперсная фаза - газ, а дисперсионная среда - жидкость, вытянутая в тонкие пленки. Если
концентрация дисперсной фазы (газа) в системе невелика и пузырьки газа не связаны между собой, а свободно перемещаются в жидкости, то это аэрированная жидкость. И лишь высококонцентрированные ячеисто-плѐночные связные дисперсные системы являются пенами. По своему строению пены подобны
высококонцентрированным желатинированным эмульсиям и такие же твердообразные.
Благодаря избытку газовой фазы и взаимному сдавливанию пузырьки пены представляют собой полиэдрические ячейки, стенки которых состоят из очень тонких пленок жидкой дисперсионной среды (рис. 4).
От типичных пен, представляющих высококонцентрированные дисперсии газа в жидкости, следует отличать низкоконцентрированные системы газ - жидкость, в которых газовые пузырьки находятся на сравнительно большом расстоянии друг от друга. Примером такой дисперсной системы может служить газированная вода,
содержащая пузырьки двуокиси углерода. Благодаря большой разнице в плотностях жидкой и газовой фаз такие системы обладают очень малой седиментационной устойчивостью и существуют непродолжительное время.
Пеной может быть не всякая дисперсная система типа газ - жидкость, а только ячеисто-пленочная, т. е. такая, в которой отдельные пузырьки связаны друг с другом разделяющими их пленками в общий каркас.
В пене газовый пузырек не может свободно перемещаться ни в вертикальной, ни в горизонтальной плоскости, он как бы зажат другими пузырьками, прилегающими к нему. Такая плотная упаковка достигается лишь при определенном соотношении объемов жидкой и газовой фаз. При значительном насыщении пены воздухом пузырьки теряют сферическую форму и превращаются в многогранники, а разделяющие их пленки приобретают одинаковую толщину во всем объеме пены. Получается пространственная конструкция, в разрезе похожая на пчелиные соты. При образовании пены такая конструкция возникает самопроизвольно; в ней на каждом ребре многогранника сходятся три тонкие пленки, образуя угол в 120°. Эта пена характеризуется минимальной поверхностной энергией, и, следовательно, она наиболее устойчива.
 Межфазное натяжение. Для создания стабильных, устойчивых систем (буровых и тампонажных растворов) и направленного регулирования их свойств необходимо рассмотреть физико-химические основы
Межфазное натяжение. Для создания стабильных, устойчивых систем (буровых и тампонажных растворов) и направленного регулирования их свойств необходимо рассмотреть физико-химические основы
явлений, происходящих на границе раздела фаз и обусловленных высокой степенью дисперсности составляющих компонентов.
Высокая степень раздробленности дисперсной фазы в буровых растворах обусловливает развитие поверхности
раздела (площадь поверхностей 1г бентонитовой глины
может достигать 800 - 900м2). Поэтому управление их качеством связано, прежде всего, с комплексом явлений на поверхностях твердых частиц и пузырьков газа, находящихся в дисперсионной среде.
Силы притяжения f1 и f2 поверхностных молекул,
Рис. 5. Схема компенсации
молекулярных сил в системе жидкость - газ (в объеме молекулярные силы компенсированы, на поверхности - не-
например, на поверхности раздела: жидкость - воздух или жидкость - твердое тело,
не уравновешены (рис. 5). В связи с этим поверхностные молекулы на границе раздела фаз обладают некоторой некомпенсированной избыточной энергией.
Частицы (молекулы и ионы) во внутренних слоях вещества испытывают в среднем одинаковое со стороны окружающих частиц притяжение. На молекулу,
находящуюся внутри жидкости, действуют силы взаимного притяжения (силы молекулярного сцепления) со стороны всех окружающих ее соседних молекул.
Равнодействующая этих сил равна нулю и для перемещения молекулы внутри жидкости не требуется затрачивать работу. Силы молекулярного сцепления действуют лишь на очень близких расстояниях, поэтому молекула испытывает притяжение лишь со стороны своих ближайших соседей.
Если же «вытащить» молекулу на поверхность жидкости, то для нее не все силы молекулярного сцепления будут компенсированы. Это вызвано тем, что в газообразной фазе (пар над жидкостью), молекулы удалены друг от друга на
большие расстояния: действующие между ними, силы взаимного притяжения ничтожны, и молекула практически испытывает притяжение только со стороны молекул жидкости, которое ничем не компенсируется со стороны газообразной фазы.
Когда говорят о поверхности раздела между жидкостью и газом (как правило, воздухом), то часто вместо термина «межфазное натяжение» употребляют термин
«поверхностное натяжение». Для неполярных жидкостей поверхностное натяжение меньше, для полярных - больше. При постоянной температуре поверхностное натяжение жидкостей на границе с воздухом не меняется, поскольку поверхность жидкостей является идеально гладкой и энергетически однородной в отличие от поверхности твердых тел, где проявляются различные дефекты и неоднородности.
При увеличении площади поверхностей раздела путем дробления мы выводим частицы из объемной фазы в поверхностный слой, совершая при этом работу против сил взаимодействия между ними. Эта работа в изотермических условиях пропорциональна изменению площади и равна изменению свободной поверхностной энергии. Обозначив площадь поверхности раздела S и рассмотрев процесс обратимого изменения ее на бесконечно малую величину, получим величину работы, затрачиваемой при таком процессе:
Es = σdS (5),
где σ - коэффициент поверхностного натяж


