В почве радионуклиды содержаться в водорастворимой, обменной, необменной и прочносвязанной необменной формах. Среди этих форм наибольшую играют первые две, поскольку они способны усваиваться растениями и, следовательно, мигрировать по биологической цепочке. Биологическая подвижность радионуклидов зависит, с одной стороны, от их физико-химических свойств, а с другой стороны, от свойств самой почвы, среди которых решающее значение играют ее тип, минеральный состав, кислотность, содержание органических веществ, увлажненность, длительность её использования в агроэкосистемах. Наибольшей доступностью для растений обладает стронций, который в виде 73% в глобальных выпадениях находится практически полностью в водорастворимой форме.
Большое влияние на доступность радионуклидов для растений оказывает наличие в почве обменных катионов – элементов-носителей и кислотность. Чем больше в ней элементов-носителей, тем меньше биологическая подвижность радионуклидов и наоборот. Закисление почв приводит к увеличению доступности радионуклидов для растений. Микроорганизмы почвы снижают подвижность радионуклидов в биологическом круговороте. По профилю почв естественных экосистем стронций-90 распределяется интенсивно, благодаря более высокой подвижности. Радиационно-экологическая обстановка на загрязненных территориях изменяется в основном в результате естественного радиоактивного распада, вторичного ветрового переноса и вертикальной миграции.
В растения радионуклиды могут поступать через корневую систему и аэральным путем. Большое значение в накоплении растениями радионуклидов имеет фаза вегетации. Листья молодых растений поглощают радионуклиды в значительно больших количествах, чем листья растений, заканчивающих рост и развитие. Стронций-90 под действием ветра и осадков частично удаляется с поверхности листьев и стеблей растений и перемещается в почву, а частично прочно фиксируется на поверхности растений. Выпадение радиоактивных аэрозолей на поверхность растений приводит к накоплению их в надземной массе, в то время как при корневом пути поступления, почвенный поглощающий комплекс выступает в роли мощного сорбционного фактора, а корневая система является селективным барьером, исключающим поступление в надземную фитомассу биологически инертных элементов.
Влияние почвы проявляется в снижении биологической активности радионуклидов при увеличении содержания в почве обменных катионов, органического вещества, физической глины, ила, минералов монтмориллонитовой группы, емкости поглощения. Черноземы, имеющие большое количество мелкодисперсных частиц органического вещества (гумуса) уменьшают переход радионуклидов в растения. При увеличении кислотности возрастает поступление в почву стронция-90. Большему удержанию радиоизотопов в почве способствует наличие в ней химических элементов, близких по химическим свойствам к этим изотопам. Так, кальций - химический элемент, близкий по своим свойствам стронцию - 90 и внесение извести, особенно на почвы с высокой кислотностью, ведёт к увеличению поглотительной способности стронция - 90 и к уменьшению его миграции.
Биологические особенности растений влияют на накопление ими радионуклидов. Так, стронций-90 в 2-6 раз интенсивнее накапливается в бобовых культурах, чем в злаковых. Наиболее интенсивно идет накопление радионуклидов в листьях, стеблях, слабее в генеративных органах.
Распределение радионуклидов в вертикальном профиле почв влияет на поглощение их растениями. Обработка верхнего слоя (заглубление, вспашка, фрезерование) изменяет положение его по отношению к основной массе корней и обуславливает снижение накопления радионуклидов в растениях. Захоронение загрязненного слоя почвы за пределы распространения основной массы корней. Уменьшает накопление радионуклидов в растениях в 7-11 раз.
Расчет количества радионуклидов в почве:
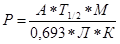
где Р – количество радионуклида, мг/м3 почвы;
А - активность радионуклида в распадах в секунду;
Т Ѕ - период полураспада изотопа в секундах;
М – массовое число изотопа;
Л – число Авогадро;
К - объем почвы 1 м3 при плотности 1,1 г/см3.
Чтобы сделать расчет количества радионуклида на 1 га, полученный результат умножают на 10000, а пересчет на 1 км3 требует умножения еще на 100, на 1 кг – на 10 -2.
Т Ѕ = 28,1 лет = 8,86 *108 сек
М=90*10-3
Л= 6,022*1023 моль-1
1 Кu = 3,7*1010 расп./сек
Р= 3,145*1011* 8,86*108*90*
10-3/0,693*6,022*1023*1=0,0609*10000=609*100
=60,9*10-2=0,609 кг
Раздел 7. РЕГЛАМЕНТИРОВАНИЕ НИТРАТОВ В ПРОДУКЦИИ РАСТЕНИЕВОДСТВА
Нитраты – соли азотной кислоты. Поглощение и включение азота в продуктивный процесс растений является важной и специфической составляющей частью круговорота азота как в глобальном масштабе, так и в пределах отдельных регионов, ландшафтов и ценозов. Основным источником азота для растений служат нитраты и аммоний. В культивируемых почвах складываются благоприятные для процесса нитрофикации условия, вследствие чего основной для растения формой как на удобряемых, так и на неудобряемых почвах являются нитраты. При недостатке, как и при избытке азота нарушаются процессы морфогенеза и накопления сухого вещества, изменяется характер включения поглощенного азота в синтез органических соединений, происходит накопление нитратов в урожае культур. Образование нитратов представляет собой естественный процесс превращения азота в геологических породах, почве, воде и атмосфере. При антропогенном воздействии на почву подвижность органического вещества повышается, усиливается минерализация азота почвы, в результате чего возрастает поступление нитратов в природные воды и растения. Азотные удобрения представляют собой главный антропогенный источник азота. Попадая в почву азотные удобрения расходуются не полностью, т.к. растения в процессе всего питания используют и почвенный азот. Поэтому конкретная система применения азотных удобрений должна соответствовать почвенно-экологическим условиям, характеру землепользования, специализации севооборотов и чередованию культур, биологическим их особенностям, поскольку несоблюдение этих условий приводит к увеличению потерь азота удобрений. Необходимо учитывать особенности рельефа местности, гранулометрический состав, водно-физические свойства почвы и другие почвенно-экологические параметры при применении азотных удобрений. Накопление азота зависит также от залужения земель. Потери азота удобрений в нитратной форме возрастают при высокой насыщенности севооборотов пропашными культурами и систематическим применением повышенных доз азотных удобрений. Неравномерное распределение азотных удобрений по поверхности почвы в ходе их внесения также можно рассматривать как одну из причин насыщения водоемов нитратами и их накопления в растениях, так как в этом случае создаются переудобренные участки, снижается коэффициент использования азота удобрений растениями, возрастают потери азота. Замена традиционных систем земледелия с участием и чередованием разнообразных культур более интенсивными и специализированными технологиями, которые способствуют усилению минерализации органического вещества почвы и разрушению ее структуры, ограничение площадей, занятых травами. Утяжеление машин и их использование на постоянных технологических колеях, отсутствие защитных зон вокруг полей приводит к усилению внутрипочвенного и поверхностного выноса азота. Одним из основных факторов, влияющим на накопление нитратов в растения является: чрезмерное внесение удобрений, особенно их нитратных форм (аммиачная, калийная, натриевая селитра). Подкармливать растения лучше амидными или аммонийными формами удобрений, т.к. аммиачный азот поглощается растениями и сразу включается в аминокислоты и белки без накопления нитратов. Увеличение количества нитратов в продукции можно получить при избыточном внесении в почву органических удобрений. Подкормка азотом за 1-2 недели до уборки урожая ведет к увеличению содержания нитратов в растительной продукции. При дефиците фосфора и калия затормаживается процесс образования органического вещества в процессе фотосинтеза, в результате чего снижается расход поступившего азота на процессы роста, что приводит к увеличению концентрации нитратного азота в органах растений. Из микроэлементов наиболее важным для предотвращения накопления нитратов является молибден, т.к. он входит в состав нитратредуктазы и принимает участие в восстановлении нитратов.
Из остальных агротехнических факторов выращивания растений влияние на концентрацию нитратов оказывают освещенность, влагообеспеченность, температура выращивания и сроки уборки урожая.
При слабой освещенности нитраты не полностью превращаются в аминокислоты. В засушливые годы при внесении высоких доз азотных удобрений в почву растения накапливают больше нитратов, поэтому необходим регулярный полив растений, чтобы азотное питание было умеренным и равномерным. Температурный фактор особенно влияет на содержание нитратов у растений, выращенных в условиях короткого светового дня. При умеренной температуре (13-23˚С) растения содержат меньше нитратов, чем при низкой или высокой. В недозрелых овощах содержание нитратов значительно выше, чем в спелых. Накопление нитратов различными культурами имеет наследственно закрепленный характер, т.е. они обладают сортовой спецификой, которая выявлена у ряда сортовых культур.
Существует несколько путей образования и накопления нитратов в растениях:
1) нитраты накапливаются в растениях в результате чрезмерного потребления растениями азота при различных факторах, способствующих более интенсивному поступлению азота в растение, нежели их ассимиляции;
2) накопление нитратов в растениях может быть следствием снижения поступления нитратного азота и замедления синтетических процессов, из-за несбалансированного питания растений азотом и другими элементами;
3) нитраты образуются в растениях в результате первичной реакции на дефицит азота, что в свою очередь связано со снижением активности нитраредуктазы;
4) нитраты образуются в растениях при избыточном усвоении аммонийного азота.
Нитраты в растениях восстанавливаются до нитритов. Опасность нитратов и их токсическое действие на организм состоит в том, что нитраты, превратившись в ЖКТ в нитриты, попадают в кровь и окисляют двухвалентное железо гемоглобина в трехвалентное. При этом образуется метгемоглобин, не способный переносить кислород к тканям и органам, в результате чего может наблюдаться удушье. Угрозой для жизни является накопление в крови 20% и более метгемоглобина.
Таким образом, токсичность нитратов относительно низкая, а их негативное действие обусловлено нитритом, продуктом восстановления NO3 в NO2 микрофлорой пищеварительного тракта и тканевыми ферментами. В этом состоит потенциальная опасность нитратов, а именно их переходом в нитриты и нитрозосоединения, которые являются канцерогенами.
При сравнении содержания нитратов в зерне и соломе овса 130 мг/кг с ПДК (250-400 мг/кг), можно сделать вывод, что данная продукция безвредна и может использоваться в качестве корма сельскохозяйственных животных, а зерно также может быть использовано на продовольственные цели.
Таблица 9
Определение путей использования продукции растениеводства
| № п/п | Полученная продук-ция | Содержа-ние нитратов, мг/кг | ПДК, мг/кг | Мероприятия, уменьшающие количество нитратов в полученной продукции | Пути использования |
| 1. | Зерно | 250-400 | Строго нормиро-ванное внесение азотных удобрений, внесение их весной под вспашку, введение севооборо-тов, использование комплексных удобрений в гранулированном и крупнокристаллическом виде | Продовольственные цели, на корм с/х животных | |
| 2. | Солома | 250-400 | -«-«-«-«-«-«-«-«-«-«-«- | На корм с/х животных |
Таблица 10
Содержание нитратов в продукции растениеводства
| Наименование культуры | Фактическое содержание нитратов, мг/кг | ПДК, мг/кг |
| Баклажаны | 80-270 | |
| Горошек зеленый | 20-80 | |
| Капуста белокочанная | 600-3000 | |
| Кабачки | 400-700 | |
| Картофель | 40-980 | |
| Лук зеленый | 40-1400 | |
| Лук репчатый | 60-900 | |
| Морковь | 160-2200 | |
| Огурцы | 80-560 | |
| Перец сладкий | 40-330 | |
| Редис | 400-2700 | |
| Свекла столовая | 200-4500 | |
| Томаты | 10-190 | |
| Фасоль | 20-900 | |
| Чеснок | 40-300 | |
| Бобы | 30-100 | |
| Виноград | 1-35 | |
| Гречиха | 10-200 | |
| Груша | 10-90 | |
| Кукуруза сахарная | 5-15 | |
| Кукуруза (зеленая масса) | 200-450 | |
| Овес | 250-400 | |
| Пшеница озимая | 30-70 | |
| Подсолнечник | 10-1650 | |
| Рапс кормовой | 10-120 | |
| Рожь озимая | 20-60 | |
| Свекла кормовая | 100-400 | |
| Свекла сахарная | 200-500 | |
| Соя | 5-25 | |
| Ячмень | 30-90 | |
| Яблоня | 2-15 |
Локализация нитратов в органах растения увеличивается в ряду:

 Репродуктивные органы листья корни, стебли, черешки листьев
Репродуктивные органы листья корни, стебли, черешки листьев
Раздел 8. МЕТОДЫКОНТРОЛЯ ЗА СОДЕРЖАНИЕМ ТОКСИКАНТОВ В ПРИРОДНЫХ СРЕДАХ И СЕЛЬСКОХОЗЯЙСТВЕННОЙ ПРОДУКЦИИ
Для получения объективной информации о состоянии и об уровне загрязнения различных объектов окружающей среды (атмосферный воздух, вода, почва) необходимо располагать надежными методами анализа. Методы применяют в широком интервале концентраций элементов, включающих как следовые количества в незагрязненных объектах фоновых районов, так и высокие значения концентраций в антропогенных условиях.
Физико-химические методы количественно определяемых остатков пестицидов:
Фотометрический метод основан на сравнении оптических плотностей исследуемой и контрольной жидкостей. К разновидностям фотометрического метода относятся фотоколометрический, спектрофотометрический, турбидиметрический, нефелометрический и флуориметрический (люминисцентный). Чувствительность определения фотоколориметров зависит от природы соединений и составляет для органических соединений 0.04-20 мг/мл пробы и для органических соединений 0,02-10 мкг/мл пробы.
Спектрофотометрический метод основан на тех же принципах. Что и фотоколориметрический, но в спектрофотометре используется поглощение монохроматического света. Чувствительность определения органических и неорганических соединений находится на уровне 0,08-20 мкг/мл пробы.
Турбидиметрический метод применяется для определения количеств веществ, которые находятся во взвешенном состоянии, посредством измерения интенсивности прохождения света через контролируемый раствор пробы. Метод пригоден для измерения концентраций порядка нескольких частей на миллион.
Нефелометрический метод отличается от турбодиметрического тем, что измеряется не прошедший через суспензию свет, а рассеянный, благодаря чему данный метод является более чувствительным для сильно разбавленных суспензий.
Флуориметрический метод используется для аналитических целей и основан на способности некоторых веществ при возбуждении ультрафиолетовым излучением сильно флуоресцировать. Этот метод имеет ограниченное применение. Точным и чувствительным он является для интенсивно флуоресцирующих веществ.
Полярографический метод основан на восстановлении анализируемого соединения на ртутном капающем электроде и используется при анализах следовых количеств веществ, находящихся в разных агрегатных состояниях.
Газохроматографический метод основан на селективном разделении соединений между двумя несмешивающимися фазами, одна из которых неподвижна (жидкость или твердое тело), а другая подвижна (инертный газ-носитель). Данный метод позволяет определять ничтожно малые количества веществ, не обладающих специфическими реакциями, анализировать смеси. Состоящие из десятков и сотен компонентов с близкими свойствами.
Масс-спектрометрический метод заключается в ионизации газообразной пробы электронной бомбардировкой, после чего образующиеся ионы подвергаются воздействию магнитного поля. В зависимости от массы и заряда ионы отклоняются с различной скоростью и соответствующим образом разделяются. Особенностью метода является малый объем пробы и высокая избирательность.
Спектрально-химический метод заключается в сочетании двух последовательных операций: 1) соосаждения групп элементов из растворов с помощью 2,4-динитроанилина; отделения их и соосаждения их фильтра молибдена с помощью «окисленного» красителя Стенгауза; 2) спектральное определение соосажденных элементов в зольном остатке с использованием соответствующих искусственных стандартов.
Спектрально-эмиссионный метод основан на излучении световой энергии атомами, ионами, реже молекулами. Излучаемые атомами и ионами эмиссионные линейчатые спектры не зависят от вида химических соединений, из которых состоит исследуемое вещество. Поэтому этот вид анализа применяется для определения элементарного (атомного) состава проб воды и почвы. Универсальность, высокая чувствительность, хорошая точность и экспрессивность определения обусловили широкое распространение метода. При фотографической регистрации спектра метод дает принципиальную возможность одновременно анализировать до 30 элементов в одной пробе, при этом в пробе почвы и воды могут быть определены очень низкие концентрации многих элементов.
Атомно-абсорбционный спектральный анализ основан на использовании способности свободных атомов элементов селективно поглощать резонансное излучение определенной для каждого элемента длины волны. Этот метод отличается универсальностью, простотой выполнения и высокой производительностью.
Биологические методы количественного определения пестицидов основаны на использовании зависимости между дозой пестицида и эффектом его действия на тест-объект. При определении инсектицидов эффект действия выражается в процентах гибели тест-объектов. При определении эффекта действия фунгицидов учитывается по величине и интенсивности роста колоний гриба – тест-объекта или по радиусу стерильной зоны, образующейся вокруг точки внесения фунгицида в среду культивируемого объекта.
Эффект действия гербицидов чаще всего устанавливается по накоплению сухой массы надземной части растения, по интенсивности роста корней или по активности отдельных звеньев фотосинтеза.
Брометод предусматривает в строго контролируемых условиях зависимости «эффект-доза» и определения эффекта действия исследуемого образца. Для этого в опыте должны быть как минимум следующие варианты сред:
1. Контроль (определенный материал без пестицида) для учета состояния тест-объекта в условиях опыта.
2. Определяемое вещество, внесенное в исследуемый материал, не содержащий пестицида, в 4-6 логарифмически снижающихся дозах с целью получения данных, необходимых для построения графика «эффект-доза», выражающего зависимость действия определенного пестицида от его дозы.
3. Исследуемый материал, содержащий определенный пестицид и используемый для установления эффекта действия на тест-объект исконных количеств пестицида. Далее по графику «эффект-доза» находят искомое количество пестицида.
Методы отбора проб и определения остаточных количеств токсикантов.
На основании анализа объединенной (средней) пробы делают заключение о всей партии пищевых продуктов или обо всем объеме почвы в целом. При определении остатков пестицидов в различных объектах важно отобрать пробу таким образом, чтобы она полностью характеризовала анализируемый объект. При этом учитываются все факторы, влияющие на устойчивость остатков, как на поверхности, так и внутри биологического материала.
Из партии пищевого продукта составляют образец. Размер отбираемой из него объединенной пробы зависит от вида исследуемого материала и целей анализа.
Средний образец овощей и корнеплодов (томат, свекла, перец, баклажан) отбирается по диагонали участка с промежутками в 6-10 растений. Плоды берут с различных ярусов (овощи) не менее, чем с 10 растений в каждой точке отбора или по диагонали участка в разных точках отбора (корнеплоды).
Образцы используют для отбора объединенной пробы овощей и корнеплодов. Каждый плод делят на 4 части и берут четвертую его часть. Затем пробу перемешивают, взвешивают, измельчают и анализируют.
Пробы почвы берут в 5-6 местах (0,5 кг в каждом месте) по диагонали участка площадью 1-5 га с различной глубины. В лаборатории высушивают до воздушно-сухого состояния в защищенном от солнечных лучей месте. После сушки измельчают и берут объединенную пробу методом квартования. Перед анализом почву просеивают через сито с диаметром 1 мм. Органические остатки анализируют с почвой или отдельно.
Анализ образцов растений на содержание остатков пестицидов проводят сразу после их взятия. Образцы хорошо упакованы, подписаны, сопровождаются паспортом, где указано:
- когда и где отобран образец,
- тип почвы, на которой выращивали культуру,
- название растения,
- наименование применяющегося пестицида,
- время обработки,
- физиологическое состояние во время обработки, для молодых растений – время со дня посева,
- препаративную форму пестицида,
- норму расхода на 1 га,
- концентрацию применяемого рабочего раствора,
- растворитель для приготовления рабочего раствора,
- расход рабочего раствора.
- число обработок,
- погодные условия в день обработки,
- за сколько дней до уборки проведено последнее опрыскивание.
Раздел 9. ПУТИ И МЕРЫСНИЖЕНИЯ ВРЕДНОГО ВЛИЯНИЯ ТОКСИКАНТОВ
Для получения экологически безопасной продукции необходимо иметь достоверные исходные данные об эколого-токсикологической обстановке в агросистемах, так как имеется вероятность с одной стороны – загрязнения биосферы токсикантами промышленного происхождения, а с другой – загрязнения среды органическими отходами сельскохозяйственного производства. Т.к. в почве содержание меди, хрома превышает ПДК, а также почва подверглась загрязнению стронцием-90, необходимо разработать комплекс мероприятий по применению веществ, улучшающих состояние экосистемы и уменьшающих переход токсикантов в растения. Существенному снижению элементов-загрязнителей способствует применение гормональных симбионтных, гуминовых препаратов, которые будучи емкими ионообменниками, поглощают подвижные формы элементов и тем самым снижают поступление их в растения.
Таблица 11
Применение веществ, улучшающих состояние экосистем и уменьшающих переход токсикантов в растения
| Название вещества | Особенности применения | Токсикант, против которого направлено действие |
| Гумат натрия | Опрыскивание растений растений в смеси с гербицидами и удобрениями, способствует повышению адаптационной способности с/х культур, снижению фитотоксичности гербицида | Снижается содержание нитратов, пестицидов, ионов ТМ (Cu, Cr, Cd) и радионуклидов (Sr-90). Имеет выраженную фунгицидную активность против возбудителей грибковых заболеваний (корневых гнилей) |
| Препараты-симбионты (симбионт 1, симбионт 2) | Препарат разводят в 10000 раз, перед высевом семена опрыскивают препаратом, подсушивают. Для обработки 600 кг семян зерновых культур требуется 1 мл препарата развести в 10 л воды | Стимулируют рост и развитие растений, повышая их устойчивость к неблагоприятным условиям, защищают растения от патогенных грибов. |
| Вермиком-пост | Оптимальная доза внесения 30 т/га | Гуминовые кислоты обладают хорошей аккумулятивной способностью. Способен связывать радионуклиды, ограничивать поступление в растения нитратов и ТМ, обладает бактерицидными свойствами. |
Литература
1. Догадина М.А., Степанова Л.П., Лысенко Н.Н. Основы токсикологии Орел: Издательство ОрелГАУ 2006
2. Догадина М.А., Лысенко Н.Н. Основы токсикологии Орел: Издательство ОрелГАУ 2008
3. Савич В.И., Парахин Н.В., Сычев В.Г., Степанова Л.П. Почвенная экология Орел: Издательство ОрелГАУ 2002
4. Степин Б.Д., Цветков А.А. Неорганическая химия М.: Высшая школа 1994
5. Список пестицидов и агрохимикатов разрешённых к применению Российской Федерацией, 2008 г. / Приложение к журналу «Защита и карантин растений» № 6 – 2008 г.
6. Баздырев Г.И. Защита сельскохозяйственных культур от сорных растений. – Москва: Колос, 2004 г. – 328 с.
7. Чесалин Г.А. Сорные растения и борьба с ними М.: Колос, 1975 г.-186 с.
8. Горленко М.В. Фитопатология Л.: Колос 1980 г. -318 с.
9. Осмоловский Г.Е., Бондаренко Н.В. Энтомоголия Л.: Колос – 1980 г. – 358 с.
10. Гигиенические нормативы содержания пестицидов в объектах окружающей среды ГН 1.2.1323-03
11. Санитарные правила и нормы СанПиН 2.3.2.560-96 "Гигиенические требования к качеству и безопасности продовольственного сырья и пищевых продуктов"