Задание на сегодня
Продолжаем проходить тему Металлы, необходимо делать конспекты в рабочих тетрадях, могу проверить выборочно или перед зачетом. По окончании изучения темы будет проверочный онлайн тест.
Общие способы получения металлов. Металлотермия.
Способы получения металлов обычно разделяют на три типа:
 Гидрометаллургически получают (методы получения металлов, основанные на химических реакциях, протекающих в растворах): золото, цинк, никель и некоторые другие металлы.
CuSO4 + Fe –> FeSO4 + Cu
Электрометаллургически получают (выделение металлов из их солей и оксидов под действием электрического тока): щелочные и щёлочноземельные металлы, алюминий, магний и другие металлы.
Гидрометаллургически получают (методы получения металлов, основанные на химических реакциях, протекающих в растворах): золото, цинк, никель и некоторые другие металлы.
CuSO4 + Fe –> FeSO4 + Cu
Электрометаллургически получают (выделение металлов из их солей и оксидов под действием электрического тока): щелочные и щёлочноземельные металлы, алюминий, магний и другие металлы.
 При разработке технологии получения химических веществ используются законы термодинамики, кинетики, теплотехники, физико-химического анализа и др. Учитываются, естественно, и экономические условия. В случае, если реакция обратима, применяется принцип Ле Шателье:
Если на систему, находящуюся в равновесии, воздействовать извне, то равновесие в системе сместится в сторону той реакции (прямой или обратной), которая приводит к частичной компенсации этого воздействия.
Химические методы применяются и при очистке выбросов, а также сточных вод химических производств.
Общие способы получения металлов
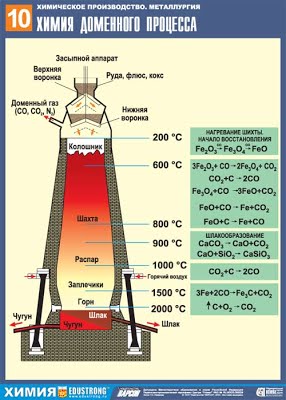
1. Восстановление металлов из оксидов углем или угарным газом
MеxOy + C = CO2 + Me,
MеxOy + C = CO + Me,
MеxOy + CO = CO2 + Me
Например,
ZnOy+ C t= CO + Zn
Fe3O4+ 4CO t= 4CO2 + 3Fe
MgO + C t= Mg + CO
2. Обжиг сульфидов с последующим восстановлением (если металл находится в руде в виде соли или основания, то последние предварительно переводят в оксид)
1 стадия – MеxSy+O2=MеxOy+SO2
2 стадия - MеxOy + C = CO2 + Me или MеxOy + CO = CO2 + Me
Например,
2ZnS + 3O2 t= 2ZnO + 2SO2↑
MgCO3 t= MgO + CO2↑
3 Алюмотермия (в тех случаях, когда нельзя восстановить углём или угарным газом из-за образования карбида или гидрида)
MеxOy + Al = Al2O3 + Me
Например,
4SrO + 2Al t= Sr(AlO2)2 + 3Sr
3MnO2 + 4Al t= 3Mn + 2Al2O3
2Al + 3BaO t= 3Ba + Al2O3 (получают барий высокой чистоты)
4. Водородотермия - для получения металлов особой чистоты
MеxOy + H2 = H2O + Me
Например,
WO3 + 3H2 t= W + 3H2O↑
MoO3 + 3H2 t= Mo + 3H2O↑
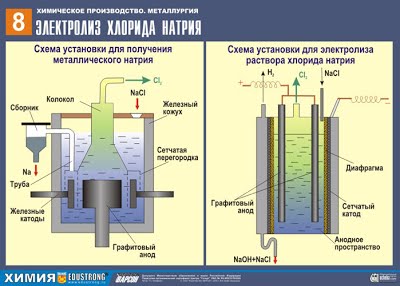
5. Восстановление металлов электрическим током (электролиз)
А) Щелочные и щелочноземельные металлы получают в промышленности электролизом расплавов солей (хлоридов):
2NaCl –расплав, электр. ток. → 2 Na + Cl2↑
CaCl2 –расплав, электр. ток.→ Ca + Cl2↑
расплавов гидроксидов:
4NaOH –расплав, электр. ток.→ 4Na + O2↑ + 2H2O (!!! используют изредка для Na)
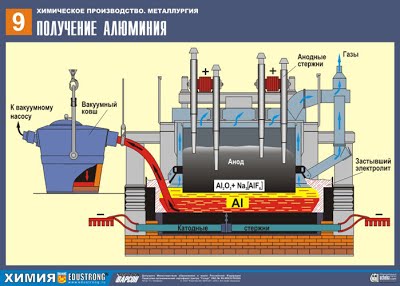
Б) Алюминий в промышленности получают в результате электролиза расплава оксида алюминия в криолите Na3AlF6 (из бокситов):
2Al2O3 –расплав в криолите, электр. ток.→ 4Al + 3 O2↑
В) Электролиз водных растворов солей используют для получения металлов средней активности и неактивных:
2CuSO4+2H2O –раствор, электр. ток. → 2Cu + O2 + 2H2SO4
При разработке технологии получения химических веществ используются законы термодинамики, кинетики, теплотехники, физико-химического анализа и др. Учитываются, естественно, и экономические условия. В случае, если реакция обратима, применяется принцип Ле Шателье:
Если на систему, находящуюся в равновесии, воздействовать извне, то равновесие в системе сместится в сторону той реакции (прямой или обратной), которая приводит к частичной компенсации этого воздействия.
Химические методы применяются и при очистке выбросов, а также сточных вод химических производств.
Общие способы получения металлов
1. Восстановление металлов из оксидов углем или угарным газом
MеxOy + C = CO2 + Me,
MеxOy + C = CO + Me,
MеxOy + CO = CO2 + Me
Например,
ZnOy+ C t= CO + Zn
Fe3O4+ 4CO t= 4CO2 + 3Fe
MgO + C t= Mg + CO
2. Обжиг сульфидов с последующим восстановлением (если металл находится в руде в виде соли или основания, то последние предварительно переводят в оксид)
1 стадия – MеxSy+O2=MеxOy+SO2
2 стадия - MеxOy + C = CO2 + Me или MеxOy + CO = CO2 + Me
Например,
2ZnS + 3O2 t= 2ZnO + 2SO2↑
MgCO3 t= MgO + CO2↑
3 Алюмотермия (в тех случаях, когда нельзя восстановить углём или угарным газом из-за образования карбида или гидрида)
MеxOy + Al = Al2O3 + Me
Например,
4SrO + 2Al t= Sr(AlO2)2 + 3Sr
3MnO2 + 4Al t= 3Mn + 2Al2O3
2Al + 3BaO t= 3Ba + Al2O3 (получают барий высокой чистоты)
4. Водородотермия - для получения металлов особой чистоты
MеxOy + H2 = H2O + Me
Например,
WO3 + 3H2 t= W + 3H2O↑
MoO3 + 3H2 t= Mo + 3H2O↑
5. Восстановление металлов электрическим током (электролиз)
А) Щелочные и щелочноземельные металлы получают в промышленности электролизом расплавов солей (хлоридов):
2NaCl –расплав, электр. ток. → 2 Na + Cl2↑
CaCl2 –расплав, электр. ток.→ Ca + Cl2↑
расплавов гидроксидов:
4NaOH –расплав, электр. ток.→ 4Na + O2↑ + 2H2O (!!! используют изредка для Na)
Б) Алюминий в промышленности получают в результате электролиза расплава оксида алюминия в криолите Na3AlF6 (из бокситов):
2Al2O3 –расплав в криолите, электр. ток.→ 4Al + 3 O2↑
В) Электролиз водных растворов солей используют для получения металлов средней активности и неактивных:
2CuSO4+2H2O –раствор, электр. ток. → 2Cu + O2 + 2H2SO4
|