Химическая кинетика – учение о скорости и механизме химических реакций. При рассмотрении вопроса о скорости реакций необходимо различать реакции, протекающие в гомогенной системе, и реакции, протекающие в гетерогенной системе.
Гомогенная система состоит из одной фазы, а гетерогенная – из нескольких фаз. Фазой называется часть системы, отделённая от других частей поверхностью раздела, при переходе через которую свойства изменяются скачком. В гомогенной системе реакция протекает по всему объёму, в гетерогенной системе – на границе раздела фаз.
Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося в результате реакции, за единицу времени в единице объёма системы. То есть скорость гомогенной реакции (υгомоген) определяется как изменение концентрации (ΔС) реагирующих веществ за единицу времени (Δτ). Средняя скорость реакции – величина положительная:
υгомоген = ± Δn/(Δτ·V) = ± ΔC/Δτ, [моль/(л·с)], где Δn – количество вещества, моль; Δτ - время реакции, с; V - объем реакционной смеси, л; ΔC - изменение молярной концентрации, [моль/л].
Скоростью гетерогенной реакции (υгетерог) называется количество вещества, вступившего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности раздела фаз:
υгетерог = ±Δn/(Δτ·S), [моль/(с·м2)], где S - площадь поверхности раздела фаз, м2.
К важнейшим факторам, влияющим на скорость реакции, относятся следующие: природа реагирующих веществ, их концентрации, температура, природа растворителя, присутствие в системе катализаторов или ингибиторов. Скорость химической реакции пропорциональна числу соударений, которое тем больше, чем выше концентрация исходных веществ.
Влияние концентрации реагирующих веществ на скорость реакции выражается законом действия масс:
при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, в степенях, численно равных коэффициентам в уравнении реакции.
Таким образом, выражение для скорости реакции в соответствии с законом действия масс для процесса: Н2 + С12 = 2НС1 будет иметь вид: υ = k[H2]·[Cl2], где [H2] и [Cl2] - молярные концентрации H2 и Cl2 [моль/л] соответственно. Если реагенты газообразны, то вместо молярных концентраций в расчетах могут быть использованы величины парциальных давлений (Р(H2) ·и Р(Cl2)) исходных газов: υ = k1Р(H2)·Р(Cl2), где k и k1-коэффициенты пропорциональности или константы скорости химической реакции. Физический смысл этой величины раскрывается при равенстве концентраций исходных веществ 1 [моль/л], тогда υ = k, то есть k – удельная скорость. Поэтому чаще скорость реакции оценивается по величине k. Для гетерогенной реакции в выражение закона действия масс входят величины концентраций только газообразных или растворённых веществ. Например, для реакции: 2С(тв.) + О2 = 2СО, υ = k·[O2], где ·[O2] - молярная концентрация [моль/л].
Зависимость скорости химической реакции от температуры выражается правилом Вант-Гоффа: при повышении температуры на 10°С скорость большинства химических реакций увеличивается в 2-4 раза:
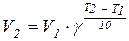
, где υ2 и υ1 – скорости реакции при температурах T2 и T1 соответственно; γ – температурный коэффициент скорости реакции (для большинства реакций он равен от 2 до 4). Более точно зависимость константы скорости от температуры описывается уравнением Аррениуса:
k = A·exp-Eа/RT, где k – константа скорости реакции, А – предэкспоненциальная постоянная, Ea – энергия активации для данного процесса, R - универсальная газовая постоянная, T - температура, K.
Всякая химическая реакция протекает через образование некоторого активированного комплекса, который затем распадается на продукты реакции. В неустойчивом промежуточном – переходном или активном комплексе - старые связи еще не полностью разорвались, а новые еще не вполне образовались, ему соответствует такое состояние системы, при котором энергия максимальна. Для перехода системы в активированный комплекс нужна энергия, равная энергии активации. Энергия активации – избыточная энергия, которой должны обладать молекулы, для того чтобы их столкновение могло привести к образованию нового вещества; это своеобразный энергетический барьер, который отделяет исходные вещества от продуктов реакции.
Катализатор – вещество, которое увеличивает скорость реакции, но при этом не расходуется в результате протекания процесса. В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. Ингибитор – замедляет реакцию, в его присутствии энергия активации увеличивается. Реакции, протекающие под действием катализаторов, называются каталитическими. Различают гомогенный и гетерогенный катализ. В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фазу (газ или раствор). В случае гетерогенного катализа катализатор находится в системе в виде самостоятельной отдельной фазы. Приведите примеры.
Контрольные вопросы:
1. Основные понятия: скорость гомогенной и гетерогенной реакции, энергия активации, переходный комплекс, катализатор.
2. Влияние различных факторов на скорость химических реакций.
3. Гомогенный и гетерогенный катализ.
Список рекомендуемой литературы (см.список, который я Вам отправляла) и дополнительные книги:
1. Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка. - М.: КНОРУС, 2009. - С. 174 - 187.
2. Коровин Н.В. Общая химия: учебник для технических направл. и спец. вузов - 7-е изд., испр. - М.: Высшая школа, 2006. - С. 166 – 181, 195 – 203.