С остояния химического равновесия в случае обратимой реакции можно достичь двумя путями:
-из начального состояния системы, в котором находятся только исходные вещества,
-либо из начального состояния системы, в котором находятся только продукты реакции.
Состояние устойчивого термодинамического равновесия в изолированной системе наступает при максимуме энтропии.
Состояние устойчивого термодинамического равновесия в закрытой системе наступает при минимуме внутренней энергии, энтальпии, энергии Гельмгольца и Гиббса в зависимости от вида реакции.
Константа химического равновесия.
Константа химического равновесия — характеристика химической реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих в-в, о максимально возможном выходе продукта реакции при тех или иных условиях. Численное значение Kp характеризует положение равновесия при данной температуре и не меняется с изменением концентрации реагирующих в-в.
aA+bB↔cC+dD
Кр=Кпр/Кобр
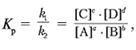
[A]a и [B]b равновесные концентрации
Отношение констант скоростей прямой и обратной реакций является величиной постоянной и называется константой равновесия
Уравнения изотермы и изобары химической реакции.
Изотерма 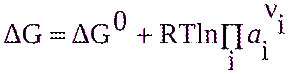 Изобара
Изобара 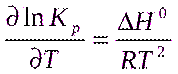
Предмет химической кинетики.
Химическая кинетика изучает закономерности протекания химических процессов во времени.
Для начала реакции необходимо ослабить и разорвать связи в молекулах исходных веществ. Затем частицы начинают двигаться и во время движения испытывают столкновения, но не все столкновения приводят к началу реакции, а только те, которые обладают избыточной энергией. Эта энергия называется энергией активации.
Скорость реакции, средняя скорость реакции в интервале, истинная скорость.
Скорость реакции – это изменение концентрации реагирующих веществ в единицу времени:
V=± 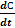
Средняя скорость в интервале – изменение концентрации реагирующих веществ за некоторый промежуток времени:
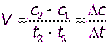 СКОРОСТЬ ВСЕГДА ПОЛОЖИТЕЛЬНА
СКОРОСТЬ ВСЕГДА ПОЛОЖИТЕЛЬНА
Истинная скорость – изменение концентрации реагирующих веществ в конкретный момент времени и представляет собой предел средней скорости при dt→0
Классификации реакций, применяющиеся в кинетике: реакции, гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряженные, цепные).
Простыми называют реакции, протекающие в одну стадию.
Сложными называют реакции, протекающие в несколько стадий.
Выделяют следующие виды сложных реакций:
1) параллельные: протекание нескольких процессов с участием одних и тех же веществ;
2) последовательные: конечные продукты образуются через ряд промежуточных продуктов,
3) сопряженные: протекание одной реакции инициирует осуществление второй;
4) цепные: протекающие через ряд регулярно повторяющихся элементарных стадий.
В гомогенных реакциях все взаимодействующие вещества находятся в одной фазе
В гетерогенных процессах реагенты, принимающие участие в реакции, находятся в разных фазах.
Микрогетерогенные реакции – это реакции происходящие в коллоидных системах.