Уравнение изобары:
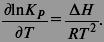
Уравнение изохоры:

25)Понятие о фазовом равновесии Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механического и химического равновесия.
Типы фазовых равновесий:
Тепловое равновесие означает, что все фазы вещества в системе имеют одинаковую температуру.
Механическое равновесие означает равенство давлений по разные стороны границы раздела соприкасающихся фаз. Строго говоря, в реальных системах эти давления равны лишь приближенно, разность давлений создается поверхностным натяжением.
Химическое равновесие выражается в равенстве химических потенциалов всех фаз вещества.
Условие равновесия фаз Рассмотрим химически однородную систему (состоящую из частиц одного типа). Пусть в этой системе имеется граница раздела между фазами 1 и 2. Как было указано выше, для равновесия фаз требуется равенство температур и давлений на границе раздела фаз. Известно (см. статью Термодинамические потенциалы), что состояние термодинамического равновесия в системе с постоянными температурой и давлением соответствует точке минимума потенциала Гиббса.
Фазовое равновесие, сосуществование термодинамически равновесных фаз гетерогенной системы. Является одним из основных случаев термодинамического равновесия и включает в себя условия равенства температуры всех частей системы (термическое равновесие), равенства давления во всем объеме системы (механическое равновесие) и равенство химических потенциалов каждого компонента во всех фазах системы, что обеспечивает равновесное распределение компонентов между фазами. Число фаз f, находящихся одновременно в равновесии, связано с числом компонентов k, числом n независимых параметров, определяющих состояние системы (обычно, когда учитывается только влияние температуры и давления, n = 2), и числом термодинамических степеней свободы v уравнением: v = k + 2 - f (см. Фаз правило). В общем виде условие фазовое равновесие, согласно принципу равновесия Гиббса, сводится к максимуму энтропии S системы при постоянстве внутренней энергии U, общего объема V и числа молей каждого компонента ni-. Этот принцип можно выразить также как условие минимума любого из термодинамических потенциалов: внутренней энергии U, энтальпии H, энергии Гиббса G, энергии Гельмгольца А при условии постоянства соответствующих параметров состояния, включая число молей каждого компонента. Фазовые равновесия могут быть стабильными и метастабильными. Те и другие являются локально устойчивыми, то есть устойчивыми по отношению к малым возмущениям параметров состояния - температуры, давления, состава (концентраций компонентов). Метастабильные фазовые равновесия отличаются тем, что они неустойчивы к некоторым конечным изменениям этих параметров, ведущим, в частности, к переходу к другим фазам. Например, пересыщенный раствор или переохлажденный расплав неустойчивы по отношению к кристаллической фазе. Поскольку метастабильное состояние системы локально устойчиво, переход к стабильному состоянию требует преодоления некоторого активационного барьера и протекания процесса зародышеобразования. Типы фазовых равновесий. В однокомпонентной системе (при наличии полиморфных превращений) возможны 4 вида двухфазных равновесий: жидкость - пар, кристалл - пар, кристалл - жидкость и кристалл - кристалл; 4 вида трехфазных равновесий: кристалл - жидкость - пар, кристалл - кристалл - жидкость, кристалл - кристалл - пар и кристалл - кристалл - кристалл; при этом не учитывается возможность образования жидких кристаллов. В двойных системах (компоненты А и В) возможны те же виды двухфазных равновесий, но число возможных видов трехфазных равновесий достигает 26 вследствие того, что играет роль не только природа сосуществующих фаз (их агрегатное состояние), но и взаимное расположение фазовых полей на диаграмме состояния в координатах температура - состав (давление предполагается постоянным). Все эти фазовые равновесия делятся на два типа: эвтектическое фазовое равновесие, при которых из трех одновременно участвующих в равновесии фаз при понижении температуры одна испытывает превращение, а две другие при этом образуются, и перитектическое фазовое равновесие, когда две фазы взаимодействуют (превращаются), при этом образуется третья фаза. В простейшем случае, если на основе компонентов А и В возможно образование жидкого раствора L и двух твердых растворов a и b, эвтектического и перитектического фазовых равновесий можно записать соответственно в виде реакций: 