Оксиды
Оксиды – это соединения, состоящие из двух элементов, один из которых кислород в степени окисления –2.
Названия состоят из: ● слова оксид;
● названия элемента с указанием степени окисления (если она переменная).
 Классификация оксидов.
Классификация оксидов.
 |

Гидроксиды – вода + оксид

Основные оксиды – это оксиды металлов в низших степенях окисления (+1,+2), которым соответствуют основания, и которые взаимодействуют с кислотами, кислотными оксидами, а некоторые – с водой.
Na2O → NaOH
CaO → Ca(OH)2
BaO → Ba(OH)2
K2O → KOH
Химические свойства основных оксидов:
1) CaO + 2HCl → CaCl2 + H2O
2) СaO + CO2 → CaCO3
3) CaO + H2O → Ca(OH)2
Кислотные оксиды – это оксиды неметаллов, а также оксиды металлов в высших степенях окисления (+5, +6, +7), которым соответствуют кислоты, и которые взаимодействуют с основаниями, основными оксидами и с водой.
СO2 → H2CO3 SO3 → H2SО4
SiO2 → H2SiO3 SO2 → H2SO3
N2O5 → HNO3 Cl2O7 → HClO4
N2O3 → HNO2 CrO3 → H2CrO4
P2O5 → H3PO4 FeO3 → H2FeO4
P2O3 → H3PO3 Mn2O7 → HMnO4
Химические свойства кислотных оксидов:
1) SO3 + 2 NaOH → Na2SO4 + H2O
2) SO3 + CaO → CaSO4
3) SO3 + H2O → H2SO4
Амфотерные оксиды – это оксиды металлов в промежуточных степенях окисления (чаще всего +3,+4), которым соответствуют и основания и кислоты, поэтому они взаимодействуют как с кислотами, так и с основаниями.
Например: ZnO, BeO, Al2O3, Cr2O3.

 Zn(OH)2 – основание Al(OH)3 – основание
Zn(OH)2 – основание Al(OH)3 – основание

 ZnO Al2O3
ZnO Al2O3
H2ZnO2 – кислота кислоты:
H3AlO3 – ортоалюминиевая
HAlO2 – метаалюминиевая
Химические свойства амфотерных оксидов:
1) ZnO +2 HCl → ZnCl2 + H2O
 2) ZnO + 2 NaOH t Na2ZnO2 + H2O
2) ZnO + 2 NaOH t Na2ZnO2 + H2O
цинкат натрия
3) ZnO + 2 NaOH + H2O → Na2[Zn(OH)4]
тетрагидроксоцинкат натрия
4) Al2O3 + 6 HCl → 2 AlCl3 + 3 H2O
 5) Al2O3 + 6 NaOH t 2 Na3AlO3 + 3 H2O
5) Al2O3 + 6 NaOH t 2 Na3AlO3 + 3 H2O
ортоалюминат натрия
 6) Al2O3 + 2 NaOH t 2 NaAlO2 + H2O
6) Al2O3 + 2 NaOH t 2 NaAlO2 + H2O
метаалюминат натрия
7) Al2O3 + 6 NaOH + 3 H2O → 2 Na3[Al(OH)6]
гексагидроксоалюминат натрия
8) Al2O3 + 2 NaOH + 3 H2O → 2 Na[Al(OH)4]
тетрагидроксоалюминат натрия
Кислоты
Кислоты: ● соединения, состоящие из атомов водорода, способных замещаться на металл, и кислотных остатков.
● электролиты, которые при растворении в воде диссоциируют на катионы водорода (Н+) и анионы кислотных остатков.
Классификация кислот




|
 |  |  |
1.  По числу атомов водорода (основности):
По числу атомов водорода (основности):
 |
HCl H2CO3 H3PO4
2. По наличию атомов кислорода:
|
|
HBr H2SO4
3. По степени растворимости в воде:
 |  |
HNO3 H2SiO3
4. По степени диссоциации (α):
 |  |
 Необходимо запомнить 6 сильных кислот и 17 слабых, а также названия их анионов.
Необходимо запомнить 6 сильных кислот и 17 слабых, а также названия их анионов.
Сильные кислоты
| Формула кислоты | Название кислоты | Название солей |
| H2SO4 | Серная | Сульфаты |
| HNO3 | Азотная | Нитраты |
| HCl | Соляная (хлороводородная) | Хлориды |
| HBr | Бромоводородная | Бромиды |
| HI | Йодоводородная | Йодиды |
| HClO4 | Хлорная | Перхлораты |
| Слабые кислоты | ||
| H2SO3 | Сернистая | Сульфиты |
| HNO2 | Азотистая | Нитриты |
| HF (H2F2) | Димер плавиковой кислоты, Фтороводородная | Фториды |
| H2S | Сероводородная | Сульфиды |
| H2CO3 | Угольная | Карбонаты |
| H2SiO3 | Метакремниевая | Метасиликаты |
| H4SiO4 | Ортокремниевая | Ортосиликаты |
| H3PO4 | Ортофосфорная | ортофосфаты |
| HPO3 | Метафосфорная | Метафосфаты |
| HPO2 | Метафосфористая | Метафосфиты |
| H3PO3 | Ортофосфористая | Ортофосфиты |
| HCN | Синильная | Цианиды |
| HMnO4 | Марганцовая | Перманганаты |
| H2CrO4 | Хромовая | Хроматы |
| H2Cr2O7 | Двухромовая | Дихроматы |
| CH3COOH | Уксусная | Ацетаты |
| HCOOH | Муравьиная | Формиаты |
Химические свойства кислот:
1) с основаниями – H2SO4 + 2 NaOH → Na2SO4 + 2 H2O;
2) с основными оксидами – H2SO4 + CuO → CuSO4 + H2O;
3) с металлами (до Н) HCl и разб. H2SO4 – 2 HCl + Zn → ZnCl2 + H2;
4) с солями слабых и летучих кислот – 2 HCl+Na2CO3 → 2 NaCl+H2O+CO2


 3. Основания
3. Основания
Основания: ● соединения, состоящие из атомов металлов и одной или нескольких гидроксильных групп (ОН−1).
● электролиты, которые при растворении в воде диссоциируют на анионы гидроксильных групп (ОН−1) и катионы металлов.
 |
Классификация оснований
 |
1. По числу гидроксильных групп (ОН−1):
 | ||||||
|
|
KOH Ba(OH)2 Fe(OH)3
2. По степени растворимости в воде:
 |  |
NaOH Ca(OH)2
3. По степени диссоциации (α):
 |  |
 Необходимо запомнить сильные основания – это основания, образованные щелочными или щелочноземельными металлами (кроме Mg и Be).
Необходимо запомнить сильные основания – это основания, образованные щелочными или щелочноземельными металлами (кроме Mg и Be).
| Сильные основания | Слабые основания | ||
| Формула | Название | Формула | Название |
| LiOH | Гидроксид лития | NH4OH или NH3 ∙ H2O | гидроксид аммония |
| NaOH | Гидроксид натрия | Fe(OH)3 | гидроксид железа (III) |
| KOH | Гидроксид калия | все остальные | |
| RbOH | Гидроксид рубидия | ||
| CsOH | Гидроксид цезия | ||
| FrOH | Гидроксид франция | ||
| Ca(OH)2 | Гидроксид кальция | ||
| Sr(OH)2 | Гидроксид стронция | ||
| Ba(OH)2 | Гидроксид бария |
Химические свойства Ме+n(OH)n-1:
1) с кислотами – 2 KOH + H2SO4 → K2SO4 + 2 H2O;
2) с кислотными оксидами – 2 KOH + CO2 → K2CO3 + H2O;
3) с солями – 2 KOH + CuSO4 → Cu(OH)2↓ + K2SO4;
4) нерастворимые основания разлагаются при нагревании –
 Cu(OH)2 t CuO + H2O;
Cu(OH)2 t CuO + H2O;
5) амфотерные гидроксиды взаимодействуют как с кислотами, так и с основаниями – Al(OH)3 + 3 HCl → AlCl3 + 3 H2O;
Al(OH)3 + NaOH → Na[Al(OH)4].
4. Соли
 |
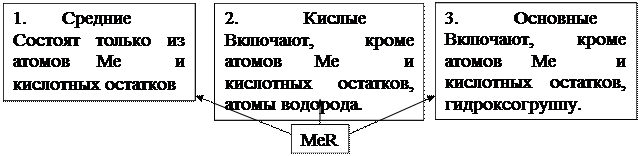
Cредние соли: ● соединения, состоящие из атомов металла и кислотных
остатков.
● электролиты, которые при растворении в воде диссоциируют на катионы металла и анионы кислотных остатков.

Al2(SO4)3 NaHCO3 MgOHCl
сульфат алюминия гидрокарбонат натрия гидроксохлорид магния
 |


|
|
 |
KAl(SO4)2 Ca(OCl)Cl K3[Fe(CN)6]
cульфат алюминия хлорид-гипохлорит гексацианоферрат (III)
калия кальция калия
Химические свойства средних солей:
1) с металлами (см. ряд напряжений) – CuSO4 + Fe → FeSO4 + Cu;
2) с кислотами – Na2CO3 + 2 HCl → 2 NaCl + CO2 + H2O
3) с солями – AgNO3 + NaCl → AgCl↓ + NaNO3.