ЛАБОРАТОРНАЯ РАБОТА № 1.12
Определение показателя адиабаты.
Цель работы: экспериментальное определение показателя адиабаты (показателя Пуассона) для воздуха путем адиабатического расширения газа.
Задание к работе:
К работе допущен:
Работу выполнил:
Работу защитил:
Введение.
Адиабатическим называют термодинамический процесс, происходящий в термодинамической системе без теплообмена с окружающей средой.
Уравнение первого начала термодинамики для произвольного термодинамического процесса имеет вид:
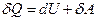 ,
,
где δQ - бесконечно малое количество тепла, подводимое к термодинамической системе; dU – бесконечно малое изменение внутренней энергии системы; δA – бесконечно малая работа, совершаемая термодинамической системой в данном процессе.
Для адиабатного процесса это соотношение принимает вид:
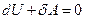 (1)
(1)
где 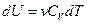
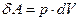
где ν – число молей вещества; Cv – молярная теплоёмкость при постоянном объеме газа; p – давление; dT и dV – бесконечно малые изменения температуры и объема газа соответственно.
Следовательно, уравнение (1) можно представить следующим образом:
 (2)
(2)
Продеффиринцируем уравнение Менделеева-Клапейрона, имеющего вид pV = νRT:

Отсюда:  (3)
(3)
Подставляя (3) в (2) получим дифференциальное уравнение, связывающее объем и давление идеального газа в адиабатическом процессе:

Учитывая, что Cv + R = Cp – молярная теплоемкость идеального газа при постоянном давлении, получим:
 (4)
(4)
Для идеального газа молярные теплоемкости Cp и Cv не зависят от температуры и определяются числом степеней свободы молекул:
 b
b 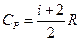
Таким образом и отношение этих величин  есть постоянная для каждого газа величина, определяемая числом степеней свободы его молекул:
есть постоянная для каждого газа величина, определяемая числом степеней свободы его молекул:
 (5)
(5)
Эта величина и называется показателем адиабаты или показателем Пуассона.
Проинтегрировав уравнение (4), получим:

или 
Из последнего равенства следует:
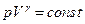
Полученное уравнение есть уравнение состояния идеального газа в адиабатическом процессе для постоянной массы газа, или его еще называют уравнением адиабаты.
Описание установок.
Одним из методов по определению показателя адиабаты метод Клемана-Дезорма.
Экспериментальная установка (рис. 1), реализующая его, состоит из стеклянного баллона 1, наполненного воздухом и соединённого с U-образным манометром 2 и через кран 3 с компрессором 4. Через клапан 5 баллон может сообщаться с атмосферой. Поперечное сечение клапана таково, что процесс установления атмосферного давления в баллоне при открытом клапане происходит достаточно быстро и практически без теплообмена с окружающей средой. Поэтому процесс, происходящий при открытом клапане 5, с достаточной точностью можно считать адиабатическим. 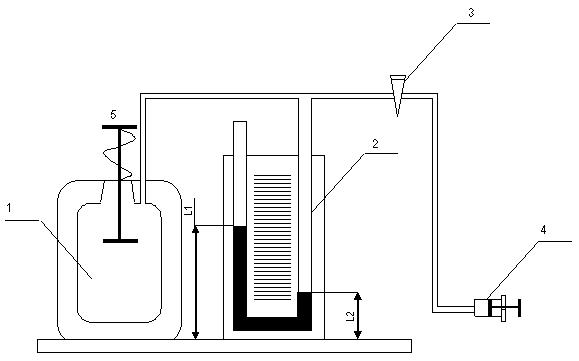
Рис. 1
В методе Клемана-Дезорпа для определения показателя адиабаты с воздухом, находящимся в баллоне, проводят последовательность термодинамических процессов, представляемых на p-V диаграмме (рис.2).
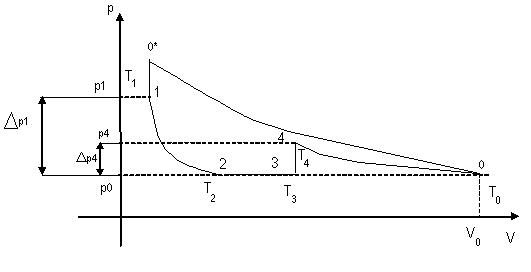
Рис.2. Диаграмма процессов в газе
Исходное состояние воздуха в баллоне охарактеризуем параметрами состояния p0, V0 , T0. Если с помощью компрессора 4 в баллон 1 закачать воздух и затем закрыть кран 3, то воздух в баллоне сжимается и нагревается (процесс 0– 0*). После этого идёт процесс изохорического остывания до температуры окружающей среды T1=T0 и воздух приобретает давление p1 (процесс 0* – 1):
 (6)
(6)
Если теперь открыть клапан 5, то воздух адиабатически расширяется (процесс 1 – 2). Воздух при этом охлаждается, и его давление становится равным атмосферному p2=p0, а температура уменьшается до величны T2<T0.
Адиабатический процесс (1 – 2), протекающий в баллоне, описывается уравнением состояния этого процесса в координатах p–T:
 или
или 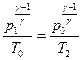 (7)
(7)
Если после достижении давления p0 (окончание адиабатического процесса) клапан 5 остается открытым в течение некоторого времени t (в эксперименте это практически всегда имеет место, т.к. адиабатический процесс длится десятые доли секунды), то происходит изобарический нагрев (процесс 2-3) за счет теплообмена воздуха со стенками баллона, а также уход части воздуха из баллона, вызванный его нагревом и расширением. Уравнение теплового баланса в этом процессе имеет вид:
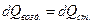
где  - количество тепла, получаемое воздухом от стенок баллона;
- количество тепла, получаемое воздухом от стенок баллона;  - количество тепла, излучаемое стенками баллона.
- количество тепла, излучаемое стенками баллона.
То есть

где m – масса воздуха в баллоне, участвующая в процессе;  - удельная теплоемкость воздуха при постоянном давлении;
- удельная теплоемкость воздуха при постоянном давлении; 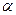 - коэффициент теплоотдачи стенок баллона; S – площадь стенок баллона; T – температура воздуха в баллоне в момент времени t.
- коэффициент теплоотдачи стенок баллона; S – площадь стенок баллона; T – температура воздуха в баллоне в момент времени t.
Разделим переменные и проинтегрируем полученное выражение с учетом того, что масса из уравнения Менделеева-Клапейрона определяется:  В этом случае будем иметь следующее уравнение:
В этом случае будем иметь следующее уравнение:
 (8)
(8)
Константу интегрирования найдем из условия протекания изобарического процесса 2-3:
при T=T2=T0-ΔT2 (9)
Тогда
 и
и 
Подставив значение “C” в (8) и пропотенцировав его, получим:
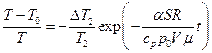 (10)
(10)
После того, как в момент времени t клапан 5 закрывается, температура воздуха в баллоне становится равной T3 и далее нагрев воздуха происходит изохорически (процесс 3-4) до температуры T4 = T0. При этом давление достигает величины p4 = p0+∆p4.
С учетом того, что в момент времени t температура T = T3, то в уравнении (10) T-T0=T3-T0. А так как T4=T3+ΔT3 и в то же время T4=T0, то T3-T0=–ΔT3. С учетом этого уравнение (10) примет вид:
 (11)
(11)
Из уравнения состояния изохорического процесса 3-4
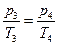 или
или 
следует, что
 (12)
(12)
Подставим значения p1 и T2 из (6) и (9) соответственно в (7) и преобразуем полученное уравнение к следующему виду:

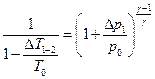 (13)
(13)
Так как 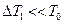 и
и 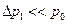 , то воспользуемся двумя первыми членами биноминального разложения выражений типа
, то воспользуемся двумя первыми членами биноминального разложения выражений типа
 и
и 
для левой и правой части выражения (13):
откуда:
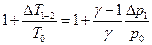
Так как  и
и  , то
, то  и следовательно получаем:
и следовательно получаем:
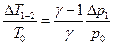 (14)
(14)
Подставив соотношение (12) и (14) в (11), получим:
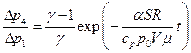 (15)
(15)
Избыточное давление, определяемое по манометру 2, выражается соотношением:

где  - плотность жидкости, используемой в манометре; g – ускорение свободного падения; h – разность уровней жидкости в манометре.
- плотность жидкости, используемой в манометре; g – ускорение свободного падения; h – разность уровней жидкости в манометре.
С учетом этого, формулу (15) можно представить следующим образом:

или
 (16)
(16)
график зависимости  от t является линейной функцией. Если экстраполировать этот график до t=0, то он будет отсекать на оси ординат отрезок (рис. 3):
от t является линейной функцией. Если экстраполировать этот график до t=0, то он будет отсекать на оси ординат отрезок (рис. 3):

Из этого выражения находится показатель адиабаты:
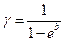 (17)
(17)
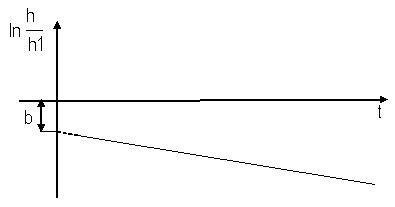
Рис.3. График зависимости  от t
от t
Порядок выполнения измерений
1. Включить электропитание стенда и компрессор.
2. Открыть кран 3 («Напуск») и комрессором 4 накачать в баллон 1 воздух так, чтобы разность уровней жидкости в манометре стала равной 25 – 30 см. Закрыть кран 3 и выждать не менее 3 – х минут, пока температура воздуха в баллоне не станет равной температуре окружающего воздуха. Определить разность уровней жидкости h1 в коленах манометра и занести это значение в таблицу, h1=L1-L2.
3. Нажать на клапан 5, соединив тем самым баллон с атмосферой. Одновременно включить секундомер. Выдержать клапан открытым в течение заданного времени. После этого отпустить клапан. Через 3 – 4 минуты определить разность уровней h в коленах манометра и записать значение h в таблицу.
4. Повторить опыты не менее 3 – х раз для каждого значения заданного времени t.