МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Имени М.В. ЛОМОНОСОВА
Биологический факультет
Кафедра биохимии
М. В. МЕДВЕДЕВА
РАСТВОРЫ
Учебно-методическое пособие
для практических занятий по биохимии
МОСКВА
УДК 577
ББК 28.072
М42
Рекомендовано кафедрой биохимии биологического факультета МГУ имени М.В. Ломоносова
Рецензенты:
Н.Б. Гусев, доктор биологических наук, профессор
А.М. Рубцов, доктор биологических наук, профессор
Пособие в первую очередь предназначено для студентов 3-го курса кафедр биофизики и биоинженерии, выполняющих практические работы в рамках раздела «Современные методы биохимии». Оно также может быть полезно для обучения студентов других кафедр биологического факультета МГУ, осваивающих навыки практической биохимии.
ISBN 978-5-317-02319-5
ОГЛАВЛЕНИЕ
| Теоретическое введение………………………………….. | |
| 1. Растворы и растворимость…………………………….. | |
| 2. Концентрация раствора и способы ее выражения…… | |
| 3. Растворители. Вода как растворитель………………... | |
| 4. Основные положения теории электролитической диссоциации……………………………………………. | |
| 5. Ионное произведение воды. Водородный показатель. | |
| 6. Способы определения рН среды……………………… 6.1. Колориметрический метод определения рН раствора с помощью индикаторов. Основные классы индикаторов ……………………………… 6.2. Потенциометрический метод определения рН раствора.................................................................... | |
| 7. Титрование. Кривые титрования……………………… | |
| 8. Буферные растворы……………………………………. | |
| Практическая часть……………………………………….. | |
| Оформление задачи………………………………………. | |
| Литература………………………………………………… | |
| Приложение……………………………………………….. |
|
|
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
1. Растворы и растворимость.
Раствор – устойчивая, однородная (гомогенная) система, включающая два или более компонентов, во всех частях одинаковая по физическим и химическим свойствам, в которой молекулы, атомы или ионы одного вещества равномерно распределены среди молекул, атомов или ионов другого (других) вещества (веществ).
Растворы занимают промежуточное положение между химическими соединениями и смесями. Как и химические соединения, они однородны и характеризуются тепловыми эффектами, а их свойства не являются суммой свойств компонентов. В отличие от химических соединений, как и смеси, растворы не подчиняются закону постоянства состава и могут быть разделены на составные части.
Если все исходные компоненты раствора находятся в одинаковом агрегатном состоянии, растворителем считается тот из них, который содержится в наибольшем количестве, а все другие - растворенные вещества. Если агрегатное состояние компонентов раствора различается, то растворителем считается то вещество, которое в чистом виде существует в том же агрегатном состоянии, что и образующийся раствор.
В зависимости от агрегатного состояния растворителя растворы могут быть газообразными (воздух), жидкими (морская вода) и твердыми (сталь) (табл. 1). В биохимии огромную роль играют жидкие (водные) растворы, поэтому мы главным образом будем рассматривать именно их.
|
|
Таблица 1. Примеры растворов.
| Тип | Фазовое состояние | Примеры | |
| раствора | растворителя | растворенного вещества | |
| Газовый* | Газ | Газ | Атмосферный воздух |
| Жидкий | Жидкость | Газ Жидкость Твердое вещество | Кислород в воде Спирт в воде Соль в воде |
| Твердый | Твердое вещество | Газ Жидкость Твердое вещество | Водород в платине Ртуть в серебре Цинк в меди (латунь) Углерод в железе (сталь) |
* Газовые растворы обычно называют газовыми смесями.
Условно принято считать молекулярными растворами системы с размерами растворенных частиц <1 нм, в то время как системы с размерами растворенных частиц >100 нм называются взвесями. Например, растворенный в воде NaCl – раствор, а мел, "растворенный" в воде, – взвесь.
Растворимость - это зависящее от природы вещества свойство растворяться в другом веществе (растворителе). Процесс растворения непосредственно связан с диффузией. Так при внесении в растворитель (например, в воду) какого-либо твердого вещества молекулы его поверхностного слоя в результате диффузии распределяются по всему объему растворителя; затем с поверхности «снимается» новый слой молекул, который в свою очередь распределяется по всему объему и т.д. Образуется качественно новая однородная система, устойчивая из-за наличия между частицами, ее образующими, сил взаимодействия физико-химической природы. Одновременно происходит обратный процесс – выделение молекул из раствора.
По мере растворения вещества концентрация раствора все более возрастает и достигает такого значения, при котором за единицу времени выделяется столько же молекул, сколько растворяется. В таком равновесном состоянии с растворенным веществом раствор называется насыщенным: больше вещества при данных условиях в нем раствориться уже не может. При меньшем содержании этого вещества раствор называют ненасыщенным. По количеству содержащегося вещества насыщенные растворы могут быть как концентрированными, так и весьма разбавленными (например, в 100 г воды растворяется 10-7 г AgI и 38 г NaCl). Определенные изменения условий (например, повышение температуры), будет сопровождаться повышением растворимости. Если затем вернуть раствор в исходное состояние, он будет содержать вещества больше, чем насыщенный раствор. Такие растворы называют перенасыщенными. Они не стойки, и избыток растворенного вещества легко выпадает в осадок. Таким образом, любой раствор в данных условиях характеризуется пределом растворимости – количеством вещества на единицу объема раствора, при котором это вещество растворяется и свыше которого оно перестает растворяться. Часто пользуются другой величиной - коэффициентом растворимости (или просто растворимостью вещества), характеризующей максимальное число граммов вещества, которое можно растворить в 100 г растворителя при данной температуре и давлении.
|
|
По растворимости (в частности, в воде в качестве растворителя) все вещества делятся на три группы: 1) хорошо растворимые (сахар, поваренная соль, медный купорос; спирт, ацетон; аммиак, хлористый водород), 2) малорастворимые (гипс, сульфат свинца; бензол, эфир; метан, азот, кислород, углекислый газ), 3) нерастворимые* или практически нерастворимые (стекло, керосин, инертные газы). (Граница между второй и третьей группой веществ достаточно условна). Кроме того, в одних случаях компоненты раствора могут смешиваться друг с другом во всех отношениях (например, спирт и ацетон в воде), в других - только ограниченно (эфир в воде), лишь до образования насыщенного раствора (максимальное содержание растворенного бутилового спирта в воде около 6%) или не смешиваться вовсе (ртуть в воде).
Факторы, влияющие на растворимость. Растворимость веществ зависит: 1) от природы самого растворяемого вещества; 2) от природы растворителя; 3) от концентрации раствора; 4) от присутствия в растворе других растворенных веществ; 5) от условий протекания процесса растворения: давления и температуры.
Растворение веществ зачастую сопровождается тепловым эффектом. В зависимости от природы вещества обычно происходит или выделение, или поглощение теплоты. Это связано с тем, что при образовании раствора связи между частицами каждого из компонентов (растворяемого вещества или растворителя) заменяются связями между частицами разных компонентов. Чтобы новые связи могли образоваться, компоненты раствора должны иметь сходные связи, т.е. быть одной или близкой химической природы (ионные вещества хорошо растворяются в полярных растворителях и хуже в неполярных, а вещества, не диссоциирующие в растворе на ионы, - наоборот). Отсюда следует найденное опытным путем правило, согласно которому «подобное растворяется в подобном ». Однако многие вещества занимают промежуточное положение между типично полярными и типично неполярными соединениями, и для них использование вышеупомянутого правила затруднено. К сожалению, единой научной теории, способной предсказать растворимость веществ в тех или иных растворителях не существует.
__________
* Абсолютно нерастворимых веществ в природе не существует. Даже металлическое золото и серебро в ничтожно малых количествах растворяется в воде и, как известно, такие растворы обладают слабыми антисептическими свойствами.
При растворении различных веществ выделяется или затрачивается энергия. Так при растворении в воде едкого натрия, серной кислоты и т.п. выделяется такое большое количество теплоты (процессы являются экзотермическими (DG<0)), что вода может закипеть (поэтому необходимо добавлять небольшие количества кислоты или щелочи в воду, а не наоборот). При растворении нитрата аммония происходит поглощение энергии и охлаждение раствора (до температуры ниже 00С), поскольку процесс является эндотермическим (DG>0) (этот эффект используется для приготовления мороженного в домашних условиях).
В то же время многие растворы образуются без заметных тепловых эффектов, как будто происходит простое механическое смешивание молекул составляющих раствор компонентов (так происходит, например, растворение двух неполярных жидкостей, имеющих близкие температуры кипения - тетрахлорида углерода ССl4 и гексана С6Н14).
Зависимость растворимости от внешних воздействий: температуры, давления, изменения состава системы подчиняется общему принципу смещения равновесия, сформулированному в 1884 году французским физикохимиком А. Ле Шателье (правило Ле Шателье). Согласно нему, если система находится в состоянии термодинамического равновесия, то при действии на нее сил, вызывающих нарушение равновесия, система переходит в такое состояние, в котором эффект внешнего воздействия ослабевает. Следовательно, если при образовании раствора выделяется теплота (реакция экзотермическая), то с повышением температуры (которая прежде всего влияет на процесс диффузии) растворимость уменьшается, т.е. равновесие системы смещается в сторону образования исходных веществ. И наоборот, если при образовании раствора теплота поглощается (реакция эндотермическая), то с повышением температуры растворимость увеличивается.
Для большинства твердых веществ с повышением температуры растворимость, как правило, значительно увеличивается. Однако бывают и исключения. Так с увеличением температуры растворимость в воде NaCl и AlCl3 практически не меняется, а Li2SO4, Ca(OH)2, Ca(CH3COO)2 даже уменьшается. Растворимость глауберовой соли Na2SO4 ×10H2O с увеличением температуры до 320С повышается, но при дальнейшем повышении температуры начинает понижаться.
Взаимная растворимость жидкостей друг в друге с ростом температуры, как правило, также повышается, а газов в жидкости, напротив, понижается. Это утверждение можно продемонстрировать следующими примерами: 1) каждый не раз наблюдал, что при нагревании холодной воды до комнатной температуры на стенках сосуда происходит выделение воздуха; 2) в одном объеме воды при 00С растворяется 1200 объемов аммиака, а при 200С - всего лишь 700 объемов.
Растворимость газов в жидкостях увеличивается с повышением давления и подчиняется закону Генри: растворимость газа пропорциональна его парциальному давлению. Понижение парциального давления ведет к уменьшению растворимости. Так, из приготовленного под давлением в несколько атмосфер газированного напитка при нормальных условиях будет бурно выделяться углекислый газ, поскольку в воздухе его парциальное давление составляет 0,2 мм рт. ст. И, наоборот, повышение парциального давления приводит к увеличению растворимости газов в жидкости. Например, в глубинах океанов при давлении около 10 атм вода оказывается предельно насыщенной газом. Между окружающей средой (в данном случае водой) и тканями организмов рыб, в частности жабрами, устанавливается равновесие в отношении содержания газов. Но если рыба внезапно окажется на поверхности воды, где давление падает до 1 атм, избыток газа должен будет выделиться из ее организма. В результате резкого выделения избыточного газа в крови образуется большое количество газовых пузырьков, вследствие чего у рыб выпучиваются глаза. У водолазов при нарушении правил декомпенсации (постепенного перехода от высокого давления к нормальному атмосферному давлению) возникает кессонная болезнь, признаками которой являются: зуд, боли в суставах и мышцах, головокружение, расстройство речи, помрачение сознания и даже параличи.
Изменение давления незначительно влияет на растворимость твердых веществ, т.к. при их растворении не происходит заметного изменения объема.
Растворы высокомолекулярных соединений (белков, полинуклеотидов, полисахаридов, и др.) сильно отличаются по свойствам от растворов низкомолекулярных веществ, и их рассмотрение выходит за рамки данного методического пособия.
2. Концентрация раствора и способы ее выражения.
Концентрация раствора – это количество растворенного вещества в единице объема или массы раствора. Существует несколько способов выражения концентрации растворов. Для «приблизительного» выражения концентрации применяют термины «концентрированный» или «разбавленный» раствор. Если количество растворенного вещества сравнимо с количеством растворителя (например, в 100 г воды растворяют 30 г соли), то речь идет о концентрированном растворе. Разбавленный раствор содержит малое количество растворенного вещества по сравнению с растворителем (например, 0,1 г соли на 100 г воды). Очевидно, что границы между концентрированными и разбавленными растворами условны.
Существует также множество способов «точного» выражения концентрации растворов:
2.1. Массовая доля (w) – отношение массы растворенного вещества (mi) к единице массы раствора (m), обычно выраженное в %:
w=(mi/m) ×100% (1)
Так, 30% раствор NaCl - это 3 г NaCl в 10 г раствора.
Массовая доля растворенного вещества всегда меньше 1 (100%), в то время как в 100 г растворителя может содержаться значительно больше 100 г растворенного соединения. Например, при 1000С в 100 г воды растворяется 900 г нитрата серебра, при этом получается 90%-ный раствор.
2.2. Процентная концентрация растворов может быть выражена тремя способами:
1) Весовая (массовая) процентная концентрация – число граммов растворенного вещества, содержащееся в 100 граммах раствора. Например, 5%-ный раствор NaCl содержит 5 граммов соли в 100 граммах раствора, т.е. для приготовления такого раствора берется 5 граммов соли и 95 граммов (миллилитров) воды.
2) Объемная процентная концентрация – число объемов растворенного вещества в 100 объемах раствора.
3) Так как при приготовлении разведенных растворов растворяемое вещество, переходя в раствор, занимает относительно небольшой объем, его можно не учитывать. В этом случае объемная процентная концентрация становиться – массо-объемной процентной концентрацией - количеством граммов растворенного вещества на 100 мл растворителя.
2.3. Молярная концентрация (молярность) (моль/л; М) – число молей растворенного вещества в 1 литре раствора:
М=ni/V (2)
где ni - число молей вещества
V - объем раствора (л)
В свою очередь моль – это единица количества вещества, численно равная его молекулярной массе и содержащая столько же структурных единиц (например, атомов, электронов, молекул), сколько атомов (электронов, молекул) находится в изотопе 12С массой 0,012 кг. Это число атомов для 12С равно 6х1023, т.е. один моль вещества содержит определенное (6х1023) число молекул, называемое числом Авогадро (NА).
С помощью понятия «моль» определяют молярную массу вещества (Mm) - отношение массы вещества к его количеству, выраженному в молях:
Мm = m/ni, (3)
где m – масса вещества
ni – число молей вещества
Эта величина имеет размерность кг/моль или г/моль. Молярная масса численно равна атомной массе для одноатомного простого вещества или молекулярной массе для соединения. Таким образом, 1 литр одномолярного раствора NaCl содержит 58,5 г соли.
В литературе приняты следующие обозначения:
для одномолярного раствор (1 моль/литр) - 1 М*
для двумолярного раствора (2 моль/литр) - 2 М
для децимолярного раствора (0,1 моль/литр) - 0,1 М
для сантимолярного раствора (0,01 моль/литр) - 0,01 М
для миллимолярного раствора (0,001 моль/литр) - 1 мМ
и т.д.
2.4. Моляльная концентрация (моляльность) (МА) –
число молей растворенного вещества в 1000 г растворителя. Например, один литр одномоляльного раствора NaCl состоит из 58,5 г соли и 1 кг воды. Размерность моляльной концентрации моль/кг.
2.5. Нормальная концентрация (нормальность) (N или н.)
число химических эквивалентов вещества в одном литре раствора
или молярная концентрация эквивалента. Эквивалентом соединения (элемента) называют такое его весовое количество, которое взаимодействует с одним эквивалентом водорода (1,008
_______
*В Международной системе единиц СИ упразднено использование обозначения «М» вместо моль/л, как единицы молярности. Тем не менее в химической и биохимической литературе до сих пор часто встречаются обозначения типа 0,05 М - вместо 0,05 моль/л.
весовых частей) или одним эквивалентом кислорода (8 весовых частей), или замещает эти количества в соединениях. Как для сложных веществ, так и для элементов выполняется закон эквивалентов, согласно которому химические элементы (вещества) вступают в реакции между собой в количествах, пропорциональных их эквивалентам. Следовательно, чтобы элементы (вещества) реагировали между собой без остатка, их надо брать в эквивалентных количествах. Между эквивалентом (Э), атомным весом (А) и валентностью (В) элемента существует зависимость.
Э=А/В (4)
Следовательно, в отличие от атомного и молекулярного весов, эквивалент элемента не является постоянной величиной и зависит от его валентности. Постоянные значения эквивалентов могут быть только у элементов с постоянной валентностью. Так эквивалент Na равен 23/1=23, Са - 40/2=20, Аl - 27/3=9.
Для соединений с переменной валентностью (например, Mn и Fe) нормальность их раствора в отличие от молярности будет зависеть от конкретной реакции, в которой это вещество участвует.
Для вычисления эквивалентов сложных соединений пользуются следующими правилами:
1) Эквивалент основания равен молекулярной массе основания, деленной на число ОН-групп в его молекуле, или на валентность металла:
ЭСа(ОН)2 = 74/2 = 37
ЭNaOH = 40/1 = 40
2) Эквивалент кислоты равен молекулярной массе кислоты, деленной на ее основность. Основность кислоты определяется числом атомов водорода в ее молекуле, которые могут быть замещены на металл:
ЭH2SO4 = 98/2 = 49
ЭHCl = 36,5/1 = 36,5
3) Эквивалент соли равен молекулярной массе соли, деленной на произведение валентности металла и числа его атомов:
ЭAl2(SO4)3 = 342/3×2 = 57
ЭNaCl = 58,5/1×1 = 58,5
Весовое количество сложного вещества, выраженное в граммах (миллиграммах) и численно равное его эквиваленту, называют грамм-эквивалентом (миллиграмм-эквивалентом). Например, 1) эквивалент Na равен 23 у.е., грамм-эквивалент (г-экв) Na равен 23 г и т.д.; 2) 1 литр 1 N раствора серной кислоты содержит 1 г-экв H2SO4, т.е. 49 граммов кислоты.
Если в 1 л раствора содержится 0,1 г-экв вещества, то он называется децинормальным, 0,01 г-экв - сантинормальным, 0,001 г-экв - миллинормальным.
2.6. Количество растворенного вещества в граммах, содержащееся в 1 мл раствора, называется титром раствора (Т).
Т=N×Э/1000 (5)
где N - нормальность раствора
Э - грамм-эквивалент вещества
Например: Т 0,1 N H2SO4 = 0,1х49/1000 = 0,0049 г/мл.
Хотя выражение концентрации в г/мл практически вышло из употребления, широко используются термины «титрование», «титрованный раствор», «кривые титрования» (см. ниже).
Важно уметь переходить от одного способа выражения концентрации к другому, например, от процентной концентрации к молярной или нормальной и наоборот. При этом необходимо знать исходную концентрацию раствора и его плотность. Только в сильно разбавленных растворах концентрации, выраженные в различных единицах, пропорциональны друг другу. При приготовлении водного раствора с концентрацией менее 5% его плотность можно считать равной ~1 г/cм3.
Нередко из двух уже имеющихся растворов разной концентрации нужно приготовить раствор промежуточной концентрации. Например, имеются 5%-ный и 30%-ный растворы вещества А. Необходимо приготовить 100 мл 10% раствора этого вещества. Конечно, можно разбавить в 3 раза водой 30% раствор. Но если экономичнее использовать оба раствора, то действовать можно двумя путями:
1) Для приготовления 100 г 10%-ного раствора (он содержит 0,1×100 г вещества А) надо взять х граммов 30%-ного раствора (он содержит 0,3×х г вещества А) и соответственно (100-х) г 5%-ного раствора (он содержит 0,05(100-х) г вещества А). Получаем уравнение: 0,3х+0,05(100-х)=0,1×100, откуда х равен 20, т.е. для приготовления 100 г 10%-ного вещества А надо взять 20 г 30%-ного и 80 г 5%-ного раствора (соотношение 1:4).
2) Тот же результат можно получить намного быстрее, используя так называемое «правило креста » или правило смешения. Напишем в левых углах квадрата концентрации имеющихся растворов (вверху - более высокую концентрацию), а в центре квадрата - требуемую концентрацию. Соединим вписанные цифры «крестом» и в двух правых углах квадрата запишем результат вычитания (по диагоналям) меньших концентраций из больших:
30% 5 ч


 10%
10%

5% 20 ч
Эти разности и представляют собой соотношение (массовое), в котором надо смешивать имеющиеся растворы, т.е. 5:20=1:4.
3. Растворители. Вода как растворитель.
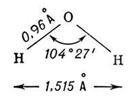
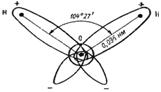
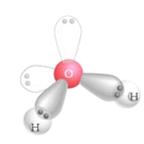
Действиевещества как растворителя главным образом определяется его способностью сольватировать растворенное вещество, т.е. образовывать с молекулами растворенного вещества связи физической или химической природы. Чем выше сольватирующая активность растворителя, тем лучше растворимость. В химической практике в качестве растворителя часто используют спирты, эфиры, ацетон, уксусную и муравьиную кислоты, бензол, пиридин. Однако важнейшим растворителем, безусловно, является вода. Во-первых, 60% всего живого и неживого нашей планеты состоит из воды, причем среднее содержание воды в живых организмах достигает 80%. Во-вторых, вода не только непосредственно участвует во многих превращениях веществ в клетках, но и является той средой, в которой протекает большинство биохимических процессов. В-третьих, благодаря своей структуре (рис. 1) вода обладает уникальными физико-химическими свойствами, которые не присущи другим растворителям.
По общепринятым на сегодняшний день представлениям молекула воды имеет четыре полюса зарядов, расположенных в вершинах тетраэдра (рис. 1, в). Такое неравномерное распределение электронной плотности обеспечивает молекуле воды ярко выраженные полярные свойства (рис. 1, а), дипольный момент составляет 1,86 Д. Вследствие этого между молекулами воды легко образуются водородные связи, которые имеют донорно-акцепторную природу (рис. 1, г). В случае воды донором неподеленной пары электронов является атом кислорода, а акцептором - подвижный атом водорода. Энергия каждой такой водородной связи ~5 ккал/моль. В жидкой воде за счет водородных связей образуются ассоциаты молекул, формирующие крупные упорядоченные структуры (рис. 1, г) и существующие в динамическом равновесии с более мелкими структурами и индивидуальными молекулами. Это равновесие зависит от температуры.
(а)(б)

(в)
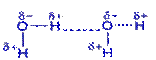
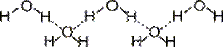
1 2
1
 3 4
3 4
(г)
Рис. 1. Общепринятые структурные модели молекулы воды.
а) диполь [https://www.biochem.arizona.edu/…/Water/water_txt.htm; https://aqua-correct.dk/dk1skw/uk-water.html]; б) плоская структура [https://www.drwater.ru/img/art/4625/91048.png; https://www.mirit.ru /rd_2007en.htm]; в) тетраэдрическая структура [https://polymer.bu.edu /Wasser/robert/work/img3.gif; https://fig.cox.miami.edu/~cmallery/150 /chemistry/sf2x7.jpg]; г) образование кристаллической структуры: (1) образование водородных связей [https://schoolchemistry.by.ru/material/p5. htm#3]; (2), (3) образование ассоциатов молекул воды [https://user.rcn.com /jkimball.ma.ultranet/BiologyPages/H/Hbonds_water.gif]; (4) кристаллическая структура [https://www.lbl.gov/…/2005/February/water-solid.html].
Структурированность воды обуславливает ее уникальные свойства: 1) аномально высокую температуру кипения (1000С); 2)
высокую теплоемкость; 3) высокую вязкость; 4) высокую теплоту испарения (541 кал/г); 5) высокую диэлектрическую проницаемость (диэлектрическая постоянная e для жидкой воды ~80; эта величина показывает во сколько раз сила притяжения между ионами (электрическими зарядами) в воде меньше, чем в вакууме (e=1)), что делает ее универсальным растворителем для большинства ионных и полярных соединений; 6) высокую ионизирующую активность, которая зависит не только от диэлектрической проницаемости растворителя, но и от его сольватирующей способности. При этом сольватами называются соединения, образованные в результате химического взаимодействия растворенного вещества с растворителем. Если в качестве растворителя выступает вода, то такие соединения называются гидратами.
Ионные или полярные молекулы растворенного вещества притягивают и удерживают вокруг себя определенное число молекул воды. В большинстве случаев такие соединения непрочны и легко разлагаются при выделении их в свободном виде. Но в ряде случаев образуются прочные соединения, которые можно выделить из раствора путем кристаллизации; при этом выпадают кристаллы, содержащие молекулы воды. Такие кристаллические вещества называются кристаллогидратами, а вода, входящая в их состав - кристаллизационной. Примерами кристаллогидратов могут быть: CuSO4×5H2O, Na2SO4×10H2O, CaCl2×6H2O, FeSO4×7H2O. Кристаллогидратами являются также и многие природные минералы.
Таким образом, вода является хорошим гидратирующим агентом, а многие вещества в воде становятся электролитами.
4. Основные положения теории электролитической диссоциации.
Электролитами называют вещества, которые в растворенном или расплавленном состоянии существуют в виде ионов и проводят электрический ток. К ним относятся многие кислоты, соли и основания, к неэлектролитам – большинство органических соединений (см. ниже табл. 2).
В растворе электролиты распадаются на ионы, причем чем больше ионов в растворе, тем лучше он будет проводить электрический ток. Сама вода очень плохо проводит электрический ток, поскольку лишь незначительное количество ее молекул распадается на ионы (см. ниже).
Полный или частичный «распад» соединений на ионы при растворении их в полярном растворителе (чаще всего в воде) или расплавлении называется электролитической диссоциацией.
Для объяснения поведения электролитов шведский физикохимик С. Аррениус предложил теорию электролитической диссоциации, за создание которой в 1903 г. был удостоен Нобелевской премии. Сущность теории сводится к следующему:
1) Электролиты при растворении в воде распадаются (диссоциируют) на положительные и отрицательные ионы.
2) Под действием электрического тока ионы движутся: положительно заряженные - катионы – к катоду, отрицательно заряженные - анионы – к аноду.
3) Процесс диссоциации обратим.
Уравнение диссоциации молекулы электролита КА на катионы
(К+) и анионы (А-) выглядит следующим образом:
КА «К+ + А- (6)
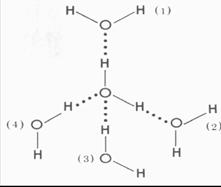
Теорию электролитической диссоциации трудно объяснить без химической теории растворов, поскольку электролитическая диссоциация обусловлена взаимодействием растворенного вещества с растворителем - сольватацией. Легче всего диссоциируют вещества с ионной связью. При растворении таких веществ диполи воды ориентируются вокруг положительных и отрицательных ионов, окружая последние (рис. 2).
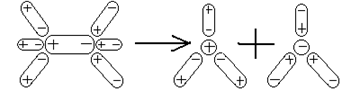
Рис. 2. Схема диссоциации полярной молекулы на ионы в воде [https://nekton.lesnoy.ru/himia.html; https://volcano4all.nm.ru/images /mg_ris2_t.gif].
По своей величине электрические заряды в дипольной молекуле воды значительно меньше заряда иона электролита, но каждый ион взаимодействует со многими молекулами растворителя. Система, в которой ионы окружены (гидратированы) молекулами воды, энергетически выгоднее системы с «голыми» ионами; т.е. «гидратная шуба» способствует диссоциации молекул электролита и препятствует обратному объединению (ассоциации) ионов в нейтральные молекулы. Гидратированные ионы могут иметь постоянный и/или переменный набор молекул воды.
Степень диссоциации. Поскольку электролитическая диссоциация – процесс обратимый, в растворах электролитов наряду с их ионами присутствуют и недиссоциированные молекулы, следовательно, растворы электролитов характеризуются степенью диссоциации a, которая представляет собой отношение числа распавшихся на ионы молекул n к общему исходному числу растворенных молекул N:
a = n/N (7)
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если a=0, то диссоциация отсутствует, если a=1 (или 100%), то электролит полностью распадается на ионы. Если же a=0,7 (70%), то это означает, что из 100 молекул данного электролита на ионы распалось 70.
На степень электролитической диссоциации оказывают влияние следующие факторы:
1) Природа растворителя. Как следует из закона Кулона
f = e1×e2/e×r2 (8)
сила электростатического притяжения (f) двух разноименно заряженных частиц зависит не только от величины их зарядов (e1 и e2) и расстояния между ними (r), но и от природы среды, в которой взаимодействуют заряженные частицы, т.е. от величины диэлектрической проницаемости среды e. У воды e=~80, тогда как у бензола e=2,3. Поэтому хлористый водород хорошо диссоциирует в воде и практически не диссоциирует в бензоле.
2) Природа растворенного вещества. По степени диссоциации в водных растворах все вещества можно разделить на электролиты и неэлектролиты. Растворение в воде неэлектролитов не приводит к появлению в растворе ионов (например, спирт). Они не проводят электрический ток, но меняют свойства растворителя (воды), - в частности, структурированность, смещая равновесие между крупными упорядоченными, более мелкими структурами и отдельными молекулами воды.
В свою очередь электролиты делят на сильные и слабые. Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы (a=0,3-1). Электролиты средней силы диссоциируют от 30 до 3%, тогда как слабые электролиты диссоциируют на ионы лишь незначительно (a<<1). Например, соляная кислота во много раз лучше диссоциирует, чем уксусная, а сахар, хорошо растворяясь в воде, вовсе не диссоциирует на ионы (a=0).
Для электролитов с многовалентными ионами характерна постепенная диссоциация. Например, диссоциация многоосновной фосфорной кислоты протекает в 3 стадии:
(1) НзРО4 ↔ Н+ + Н2РО4-
Из-за отрицательного заряда иона Н2РО4- второму протону отщепиться гораздо труднее, поэтому следующая стадия ионизации
(2) Н2РО4- ↔ Н+ + НРО42-
протекает в значительно меньшей степени. Последнему протону приходиться отрываться уже от дважды заряженного отрицательного иона, поэтому вероятность протекания третьей стадии диссоциации фосфорной кислоты в растворе много меньше протекания диссоциации по двум первым стадиям.
(3) НРО42- ↔ Н+ + РО43-
Двухосновная серная кислота H2SO4 полностью диссоциирует лишь при отщеплении одного протона, а дальнейшая диссоциация HSO4- затруднена. Примеры сильных и слабых электролитов приведены в таблице 2.
3) Температура. У сильных электролитов с увеличением температуры степень диссоциации уменьшается, у слабых проходит через максимум в области 60оС. Исключение составляет вода. Так как процесс диссоциации воды эндотермический (DН=13,7 ккал/моль), то с увеличением температуры (в соответствии с правилом Ле Шателье (см. выше)) степень диссоциации воды сильно возрастает и начинает падать лишь после 2000С.
4) Концентрация раствора. По закону разведения (см. ниже) с уменьшением концентрации раствора степень диссоциации электролитов существенно увеличивается (см. также правило Ле
Шателье). Такие растворы слабых электролитов проводят электрический ток, почти так же, как сильные электролиты.
Таблица 2. Некоторые примеры сильных и слабых электролитов.
| Сильные электролиты | Слабые электролиты |
| 1) Многие соли 2) Многие минеральные кислоты: H2SO4, HNO3, HCl, HBr, HI, HMnO4, HClO3, HClO4 3) Основания щелочных и щелочноземельных металлов | 1) Почти все органические кислоты 2) Некоторые минеральные кислоты: H2CO3, H2S, HNO2, HClO, H3PO4, H2SiO3, H3BO3, Н3AsO4 3) Большинство оснований металлов (кроме оснований щелочных и щелочноземельных металлов) 4) NH4OH |
5) Наличие одноименных ионов. Прибавление одноименных ионов уменьшает степень диссоциации (см. правило Ле Шателье).
На основании работ В.Ф. Оствальда (1893 г.) было показано, что к равновесной электролитической диссоциации веществ применим закон действующих масс (скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам в уравнении реакции).