Химические свойства спиртов, альдегидов и карбоновых кислот. Качественные реакции.
Задания.
1. Прочитайте материал, составьте конспект, в котором указаны названия и примеры химических реакций с участием спиртов, альдегидов и карбоновых кислот, заменяя R(углеводородный радикал) на группировку атомов СН3-. Отдельно выпишите качественные реакции на данные группы органических соединений.
Просмотрите видео к уроку.
На основании изученного, напишите уравнения реакций
· Внутри- и межмолекулярной дегидратации бутанола-2
· Реакции 3-метилпентановой кислоты с натрием, оксидом и гидроксидом калия
· Окисления 3-этилпентаналя (любым реагкнтом)
Химические свойства альдегидов.
Реакции присоединения.
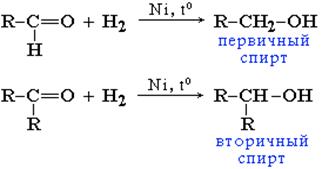
Гидрирование. Присоединение водорода по кратной связи С=О происходит при нагревании в присутствии катализаторов гидрирования (никель, платина, палладий). Альдегиды образуют первичные спирты, кетоны – вторичные спирты:
Реакции окисления альдегидов и кетонов
Альдегиды очень легко окисляются в соответствующие карбоновые кислоты под действием таких мягких окислителей, как оксид серебра и гидроксид меди (II):
а) реакция "серебряного зеркала" - окисление аммиачным раствором
оксида серебра:
R–CH=O + 2[Ag(NH3)2]OH → RCOONH4 + 2Ag + 3NH3 + H2O
б) окисление гидроксидом меди (II) с образованием красно-
кирпичного осадка Cu2O:
R – CH = O + 2Cu(OH)2 → R - COOH + Cu2O + 2H2O
Последние две реакции являются качественными на альдегидную группу.
Реакция серебряного зеркала: https://www.youtube.com/watch?v=xtaH2zmR7IY
Реакция с гидроксидом меди: https://www.youtube.com/watch?v=8ffZAEimlpg
Некоторые химические свойства спиртов.
1) Кислотные свойства:
|
|
Спирты — слабые кислоты, могут образовывать соли с активными металлами.
Например: СН3-ОН + Na —> СН3—О — Na + Н2
Соли одноатомных спиртов называются алкоголятами.
2) Взаимодействие с галогеноводородами:
R-OH + HHal -> RHal + H2O, где Hal – Cl, Br, или I
3) Реакции дегидратации – отщепления воды.
А) Межмолекулярная дегидратация – реакция отщепления воды от двух молекул спирта (образование простых эфиров):
R-OH + R'-OH -> R-O-R' + H2O
Катализатором данной реакции служит кислота. Чаще всего используют серную кислоту. Легче всего реагируют третичные спирты.
Б) Внутримолекулярная дегидратация – это реакция отщепления воды от одной молекулы спирта::
C2H5OH -> CH2=CH2 + H2O Спирты дегидратируются по правилу Зайцева. Легче всего отщепляют воду третичные спирты. Межмолекулярная и внутримолекулярная дегидратация являются конкурирующими реакциями. Но вторая протекает при более высокой температуре.
4) Реакция этерификации – реакция спиртов с карбоновыми кислотами: https://www.youtube.com/watch?v=1K5xP4r0hKY
Спирты реагируют с кислотами при этом образуются сложные эфиры.
R'-OH + R-COOH -> R-C(O)-OR' + H2O
Химические свойства карбоновых кислот:
Кислотные свойства в случае карбоновых кислот – это свойства замещать атом водорода карбоксильной группы на атом Ме
Кислотные свойства – способность к отщеплению иона водорода.

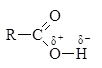
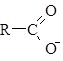 + Н+
+ Н+
В чем проявляются кислотные свойства карбоновых кислот?
1. Наличие свободного иона водорода в растворах кислот обуславливает их кислый вкус и взаимодействие с индикаторами.

2. Кислоты взаимодействуют с активными металлами, выделяя водород:
|
|
2СН3СOOH + Mg →(СН3СOO)2Mg + H2 (ацетат магния)
3. Реакции c основаниями:
СН3СOOH + NaOH → СН3СOONa + H2O.
4. Реакции с основными оксидами:
2СН3СOOH + ZnO → (СН3СOO)2Zn + H2O.
5. Реакции с солями более слабых кислот:
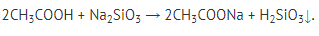
Как видно, карбоновые кислоты проявляют все свойства, характерные для минеральных (неорганических) кислот.
Качественной реакцией на карбоновые кислоты можно считать образование газа при их действии на карбонаты: https://www.youtube.com/watch?v=taldFHHswjY