ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Атомы металлов сравнительно легко отдают электроны при химических реакциях, являясь восстановителями. Это их общее химическое свойство:
Ме0 - n 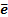 → Men+
→ Men+
I. ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ
1. С кислородом, образуют оксиды.
2Ca + O2 → 2CaO
2Сu + O2 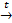 2CuO
2CuO
2. С галогенами образуют соли – галогениды: 2Na + Br2 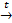 2NaBr – бромид натрия
2NaBr – бромид натрия
2Fe + 3Cl2 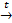 2FeCl3 - хлорид железа
2FeCl3 - хлорид железа
3. С серой – сульфиды: Fe + S 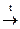 FeS - сульфид железа
FeS - сульфид железа
4. С азотом – нитриды: 6Li + N2 → 2Li3N - нитрид лития
5. С водородом – гидриды (только Ме I, II групп): 2Na + H2→ 2NaH
6. С углеродом(t) - карбиды
С кремнием(t) - силициды
II. ВЗАИМОДЕЙСТВИЕ СО СЛОЖНЫМИ ВЕЩЕСТВАМИ
- взаимодействуют согласно положению металла в ряду напряжений Ме.
Этот ряд был установлен опытным путем(эмпирически) русским ученым Н.Н.Бекетовым. для выяснения активности Ме он брал растворы солей разных металлов и опускал в них другие металлы.
Fe + CuSO4 = FeSO4 + Cu
Cu + FeSO4 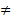
В первом случае стала выделяться чиста медь, а во втором ничего не произошло 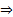 Fe активнее Cu, т.к. вытесняет ее из раствора соли. Проделав ряд таких опытов, Бекетов составил ряд напряжений металлов.
Fe активнее Cu, т.к. вытесняет ее из раствора соли. Проделав ряд таких опытов, Бекетов составил ряд напряжений металлов.
Восстановительная активность металлов возрастает. (‒ n 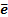 )
)

Li Cs Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H2 Sb Bi Cu Hg Ag Pd Pt Au
 Окислительная активность ионов металлов возрастает (+n
Окислительная активность ионов металлов возрастает (+n 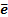 )
)
Чем левее в этом ряду стоит металл, тем он более активен.
Слева направо в этом ряду:
· Восстановительная способность металлов падает(способность отдавать 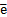 )
)
· Окислительная способность ионов металлов увеличивается(способность принимать 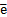 )
)
Fe0 - 2 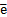 → Fe2+ - легче Fe2+ + 2
→ Fe2+ - легче Fe2+ + 2 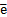 → Fe0 - труднее
→ Fe0 - труднее
Cu0 - 2 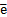 → Cu2+ - труднее Cu2+ + 2
→ Cu2+ - труднее Cu2+ + 2 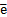 → Cu0 - легче
→ Cu0 - легче
В этом же ряду расположен водород, т.к. он как и металлы отдает 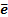 , являясь восстановителем и вытесненяет неактивные металлы из их солей.
, являясь восстановителем и вытесненяет неактивные металлы из их солей.
1. Все металлы, стоящие до водорода вытесняют его из воды:
а) щелочные и щелочно-земельные Ме(Li-Na) при н.у. с образованием щелочи:
2Na +2H2O → 2NaOH + Н2↑
б) другие Ме, стоящие до водорода, взаимодействуют при нагревании с образованием оксида Ме:
Zn + H2O 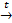 ZnO + Н2↑
ZnO + Н2↑
в) Исключение: с образованием нерастворимых гидроксидов с водой взаимодействуют:
Al при удалении оксидной пленки с его поверхности: 2Al + 6H2O → 2Al(OH)3↓ + 3 H2↑
Mg - при кипячении: Mg + 2H2O 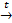 Mg(OH)2↓ + H2↑
Mg(OH)2↓ + H2↑
2. С кислотами:
а) Металлы, стоящие в ряду напряжений до водорода, вытесняют его из растворов кислот (искл. НNO3 –
водород не выделяется), если образуется растворимая соль(окислитель Н+):
Zn + 2HCl → ZnCl2 + Н2↑
б) Ме, стоящие после водорода не взаимодействуют с растворами кислот(искл. НNO3)
в) Все металлы, кроме Au, Pt, взаимодействуют с концентрированной Н2SO4, но выделяется не
водород, а другие вещества (SO2, S, H2S):
Cu + 2H2SO4 → CuSO4 + 2H2O + SO2↑
г) Все металлы, кроме Au, Pt, взаимодействуют с HNO3 любой концентрации, но при этом выделяется не Н2, а другие газы (NO, NO2 и др.): Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO2↑
3. С солями:
а) Левее стоящие металлы вытесняют из растворов солей правее стоящие металлы, если образуется растворимая соль: CuSO4 + Fe → FeSO4 + Cu
 б) Щелочные и щелочно-земельные металлы для этой реакции брать нельзя, т.к. они взаимодействуют не с солью, а с водой. Na + CuSO4: 2Na +2H2O → 2NaOH + Н2↑+ Q
б) Щелочные и щелочно-земельные металлы для этой реакции брать нельзя, т.к. они взаимодействуют не с солью, а с водой. Na + CuSO4: 2Na +2H2O → 2NaOH + Н2↑+ Q
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
Cu(OH)2 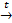 CuO + H2O
CuO + H2O
CuSO4 + 2Na + H2O → CuO + Na2SO4 + H2↑
Д/з - § 41, упр.2,3
Алгоритм решения задачи:
| 1. Внимательно прочитай условие задачи! | 30г смеси, состоящей из порошков меди ижелеза, обработали соляной кислотой. Приэтом выделилось 4,48л водорода. Вычислите массовую долю(в%) каждого металла в смеси. |
| 2. Запиши «Дано:» |  Дано:
mсмеси = 30г
V(H2) = 4,48 л Дано:
mсмеси = 30г
V(H2) = 4,48 л
 W(Fe) -?
W(Cu) -? W(Fe) -?
W(Cu) -?
|
| 3. Запиши уравнения возможных реакций. Расставь коэффициенты. Подчеркни формулы тех веществ, с которыми будешь решать задачу. Проставь под число моль под формулами(равно коэффициенту) | С соляной кислотой будет взаимодействовать только Fe, т.к. оно стоит до Н2 в ряду напряжений, Cu не вступает в реакцию с соляной кислотой,т.к. стоит после Н2. 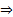 водород выделился только в реакции с железом водород выделился только в реакции с железом 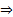 зная объём водорода - найдём массу железа.
Fe + 2HCl → FeCl2 + H2
1моль 1моль зная объём водорода - найдём массу железа.
Fe + 2HCl → FeCl2 + H2
1моль 1моль
|
| 4. Найди количество известного вещества | Находим количество вещества водорода:
n(H2) = 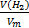 = = 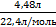 = 0,2 моль = 0,2 моль
|
| 5.Определи количество искомого вещества. | Т.к. по уравнению реакции n(Fe): n(H2) = 1: 1 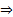 n(Fe) = n(H2) = 0,2 моль n(Fe) = n(H2) = 0,2 моль
|
| 6.Определи массу искомого вещества. | Находим массу железа по формуле: m = n•M (M(Fe) = 56г/моль) m(Fe) = 0,2 моль• 56г/моль = 11,2г |
| 7.Определи массовую долюискомого вещества в смеси | Находим массовую долю железа в смеси по формуле:
W = 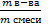 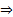 W(Fe) = W(Fe) = 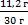 = 0,37 или 37% = 0,37 или 37%
|
| 8.Определи массовую долю второго вещества в смеси. | Находим массовую долю меди в смеси: т.к. все вещество - это 100%, то: W(Cu) = 100% - W(Fe) = 100% - 37% = 63% |
| 9.Запиши ответ | Ответ: W(Fe) = 37% W(Cu) = 63% |
Образец оформления задачи:
 Дано:
mсмеси = 30г
V(H2) = 4,48 л Дано:
mсмеси = 30г
V(H2) = 4,48 л
 W(Fe) -?
W(Cu) -? W(Fe) -?
W(Cu) -?
| Решение:
Fe + 2HCl → FeCl2 + H2
1моль 1моль
1) n(H2) = 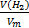 = = 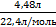 = 0,2 моль
2) n(Fe) = n(H2) = 0,2 моль
m(Fe) = 0,2 моль• 56г/моль = 11,2г
3) W = = 0,2 моль
2) n(Fe) = n(H2) = 0,2 моль
m(Fe) = 0,2 моль• 56г/моль = 11,2г
3) W = 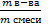 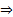 W(Fe) = W(Fe) = 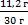 = 0,37 или 37%
4) W(Cu) = 100% - W(Fe) = 100% - 37% = 63%
Ответ: W(Fe) = 37%; W(Cu) = 63% = 0,37 или 37%
4) W(Cu) = 100% - W(Fe) = 100% - 37% = 63%
Ответ: W(Fe) = 37%; W(Cu) = 63%
|