Уравнение изотермы Вант-Гоффа
_ _ _ _
∆r GT = ∆r GºT+ RTln (peE равн pfF равн / paA равн pbB равн)=0
_ _ _ _
∆r GºT= - RTln (peE равн pfF равн / paA равн pbB равн)
Если эта гетерогенная реакция с участием газообразных компонентов протекает при V=const _ _ _ _
∆r FºT= - RTln (ceE равн cfF равн / caA равн cbB равн)
для реакции aA(р)+bB(р)+dD(к) = eE(р)+fF(р,),
протекающей в идеальном растворе
_ _ _ _
∆r GºT= ∆r FºT= - RTln (ceE равн cfF равн / caA равн cbB равн)
_ _ _ _
Кс= ceE равн cfF равн / caA равн cbB равн
_ _ _ _
Кр= рeE равн рfF равн / рaA равн рbB равн
Для газофазных реакций ∆r GºT= - RTln Кр
∆r FºT= - RTln Кc
Кр= Кс(RT)∆ν,
где ∆ν=(e+f-a-b) и R=0,082 атм·л·моль-1·К-1
Для реакций в конденсированном состоянии:
∆r GºT= - RTln Кс
В выражение для Кр и Кс не входят компоненты в более конденсированном состоянии
Таким образом, рассчитав энергию Гиббса реакции для заданной Т, можно по данным формулам рассчитать Кр и Кс при этой температуре
Значения Кр и Кс при данной температуре не зависят от величин парциальных давлений и концентраций компонентов, а также общего давления в системе, но зависят от Т и от природы реагирующих веществ.
Зависимость константы равновесия от Т – уравнение изобары Вант-Гоффа:
(dln Кр / dT)=∆rH0/RT2 При интегрировании(с учетом ∆r H0 ¹ f(T)) при Т2 > Т1:
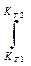
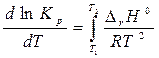 ln
ln 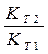 =
= 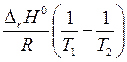
Для экзотермической реакции ∆Hr0<0 и Кр ↓ с ↑Т
Для эндотермической реакции ∆Hr0>0 и Кр ↑ с ↑Т
Смещение химического равновесия
Смещение химического равновесия - это процесс изменения равновесного состава системы вследствие изменения внешних условий и установление нового равновесного состава. Направление смещения равновесия подчиняется принципу Ле Шателье: если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-либо из условий, определяющих состояние равновесия, то равновесие смещается в сторону уменьшения эффекта внешнего воздействия.
Вывести систему из состояния равновесия можно: а) изменяя температуру, б) общее давление и в) парциальные давления газообразных реагентов или концентрации (активности) реагентов в растворах. В соответствии с данным принципом и уравнением изобары Вант-Гоффа при повышении температуры равновесие смещается в сторону эндотермической реакции, а при понижении – в сторону экзотермической реакции. При повышении общего давления равновесие смещается в сторону образования меньшего числа молей газообразных реагентов. При увеличении парциального давления исходных веществ равновесие смещается в сторону продуктов реакции, при понижении концентрации исходных веществ или при повышении концентрации продуктов реакции равновесие смещается в сторону исходных реагентов.
Равновесный состав системы, если известен начальный состав, можно рассчитать, применяя закон действующих масс и составляя уравнения материального баланса.
Пример. Определите равновесные концентрации СО2 и СО, если реакция С(к) + СО2(г) = 2СО(г) протекает при 1000 К в закрытом сосуде объемом 2 л, продукты в начальный момент отсутствуют, а исходная масса газообразного СО2 равна 44г,твердого углерода - избыток.
Решение. Рассчитаемначальную молярную концентрацию СО2: 44/(44·2)=0,5моль/л.Используем значение К с1000=0,013, полученное в предыдущем примере. Примем, что в результате протекания реакции до установления равновесия прореагировало х моль/л СО2 и образовалось в соответствии со стехиометрией реакции 2 х моль/л СО. Тогда равновесная концентрация СО2 составит (0,5- х) моль/л.
Таблица материального баланса будет иметь очень простой вид:
| компонент | С | СО2 | СО |
| С0, нач. конц моль/л | - | 0,5 | |
| ∆ С изменение конц-ции | - | х | 2х |
| Ср, равн. конц моль/л | - | 0,5-х | 2х |
После подстановки полученных выражений для равновесных концентраций в уравнение (4), имеем
Кс = (2 х)2/(0,5- х)=0,013. (Очередной раз отметим, что вещества в твердом состоянии не входят в константу равновесия). Решая уравнение относительно х, находим
х = 0,0387моль/л. Таким образом, равновесная концентрация СО равна = 2· 0,0387= 0,0774моль/л, а с равнСО2 = 0,5-0,0387=0,4613 моль/л.