Лекция 4. Газовые законы. Основные газовые процессы.
План
Газовые законы
Основные газовые процессы
Газовые законы
Под парциальным давлением газа Рп понимают давление этого газа в предположении, что при температуре смеси в объёме, занимаемом смесью, находится только рассматриваемый газ.
В соответствии с законом Дальтона, давление смеси идеальных газов равно сумме парциальных давлений этих газов: Рсмеси=Р1+Р2+Р3+…+Рn
Для описания состояния идеального газа пользуются уравнением Менделеева-Клапейрона:
РV= 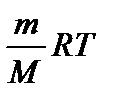 , где: P – давление газа, Па; V – объём газа, м3; T – температура газа, К; m – масса газа, кг; M – мольная масса газа, кг/моль; R=8,31 Дж/(моль*К) – универсальная газовая постоянная.
, где: P – давление газа, Па; V – объём газа, м3; T – температура газа, К; m – масса газа, кг; M – мольная масса газа, кг/моль; R=8,31 Дж/(моль*К) – универсальная газовая постоянная.
Уравнением, объединяющим газовые законы Бойля-Мариотта, Шарля и Гей-Люссака, является:
 ,
,
где индекс «0» означает начальное состояние системы, например, при нормальных условиях; индекс «1» означает некоторое конечное состояние системы.
Нормальными условиями (н.у.) считают Р0 =101,3кПа (нормальное атмосферное давление) и Т0=273К (0°С).
Объединенный газовый закон можно сформулировать следующим образом: для фиксированной массы газа произведение давления на объем, деленное на температуру, есть величина постоянная.
Молярная газовая постоянная.
Для одного моля любого газа при нормальных условиях имеем:
p = 1 атм = 1,013•105 Па,
V = 22,4 л = 0,0224 м3,
t = 0°C или T = 273 К.
Вычислим произведение давления на объем, деленное на температуру, если давление выражено в Па:
рV/T=(101325Па*0,0224м3)/273К=8,314Дж/К
Вычислим произведение давления на объем, деленное на температуру, если давление выражено в атмосферах:
рV/T=(1атм*0,0224м3)/273К=0,082 атм*м3/К
Полученные значения, отнесенные к одному молю, называются молярной газовой постоянной:
R=8,314 Дж/(моль*К), если давление выражено в Па.
R=0,082 атм*м3/(моль*К), если давление выражено в атмосферах.
Закон Бойля-Мариотта имеет несколько формулировок:
1) объем газа при постоянной температуре обратно пропорционален давлению.
Это означает, что по мере возрастания давления объем газа уменьшается.
2) При постоянных температуре и массе газа произведение давления газа на его объём постоянно.
Математическая запись закона такая:
V1/V2 = p2/p1, или р1V1=р2V2 или pV= const, при постоянной tº.
Зависимость давления газа от объема при постоянной температуре графически изображают кривой, которую называют изотермой. Изотерма газа изображает обратно пропорциональную зависимость между давлением и объемом. Кривую такого рода в математике называют гиперболой (рис.1).

Рис. 1
Закон Гей-Люссака также имеет несколько формулировок:
1) Объём газа при постоянном давлении пропорционален температуре.
2) При постоянных давлении и массе газа отношение объема газа к температуре постоянно.
Математическая запись закона такая:
V1/V2 = Т1/Т2, или V1/Т1=V2/Т2 или V/Т= const, при постоянном р.
Зависимость объема газа от температуры при постоянном давлении графически изображается прямой, которая называется изобарой (рис.2). Разным давлениям соответствуют разные изобары. С ростом давления объем газа при постоянной температуре согласно закону Бойля - Мариотта уменьшается. Поэтому изобара, соответствующая более высокому давлению p2, лежит ниже изобары, соответствующей более низкому давлению p1.

Рис. 2
В области низких температур все изобары идеального газа сходятся в точке T =0. Но это не означает, что объем реального газа обращается в нуль. Все газы при сильном охлаждении превращаются в жидкости, а к жидкостям уравнение состояния неприменимо. Именно поэтому, начиная с некоторого значения температуры, зависимость объема от температуры проводится на графике штриховой линией. В действительности таких значений температуры и давления у вещества в газообразном состоянии быть не может.
Закон Шарля также имеет несколько формулировок:
1) Давление газа при постоянном объеме пропорционально температуре.
2) При постоянных объеме и массе газа отношение давления газа к температуре постоянно.
Математическая запись закона такая:
Р1/Р2 = Т1/Т2, или Р1/Т1=Р2/Т2 или Р/Т= const, при постоянном V.
Эта зависимость изображается прямой, называемой изохорой (рис.3). Разным объемам соответствуют разные изохоры. С ростом объема газа при постоянной температуре давление его согласно закону Бойля - Мариотта падает. Поэтому изохора, соответствующая большему объему V2, лежит ниже изохоры, соответствующей меньшему объему V1.

Рис.3
В соответствии с уравнением Р/Т= const все изохоры идеального газа начинаются в точке T =0. Значит, давление идеального газа при абсолютном нуле равно нулю.
Закон Авогадро: в равных объемах различных газов при постоянной температуре находится одинаковое число частиц.
Отсюда вытекают следствия:
1) один моль любого газа содержит 6,025.1023 молекул
2) при нормальных условиях 1 моль газа занимает объем 22,4 дм3.
Законы идеальных газов не применяют для реальных газов, поскольку в реальных газах нельзя пренебречь силами взаимодействия между молекулами и объемом их молекул.
Плотность любого газа можно определить как:
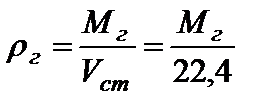 , кг/м3.
, кг/м3.
где Мг – мольная масса газа;
Vст=22,4 л/моль – объём, занимаемый 1 молем любого газа при н.у. (стандартный объём).
Плотность смеси газов определяется следующим образом:
 , кг/м3.
, кг/м3.
где ri – плотность итого газового компонента смеси, кг/м3;
gi – объёмное содержание итого газового компонента смеси, %;
n – количество газовых компонентов смеси.
Например, плотность атмосферного воздуха при н.у. составляет 1,29 кг/м3.
Плотность функционально зависит от температуры Т и давления Р:
Выведем функциональную зависимость плотности от температуры и давления. Для этого запишем объединённое уравнение в форме:


 .
.
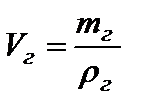
Аналогично плотности смеси газов рассчитывается мольная масса смеси газов:
 , г/моль.
, г/моль.
где Мi – мольная масса итого газового компонента смеси, г/моль;
gi – объёмное содержание итого газового компонента смеси, %;
n – количество газовых компонентов смеси.
Например, мольная масса атмосферного воздуха при н.у. составляет около 29 г/моль.
Основные газовые процессы
Процессы, в которых участвует система, могут протекать при различных условиях. В связи с этим различают следующие основные варианты реализации указанных процессов.
1. Изохорный процесс. Объём системы остаётся постоянным (dV=0). Поэтому элементарная работа расширения системы dАр=PdV=0, а вся теплота, сообщенная системе расходуется на изменение внутренней энергии, т.е. теплота приобретает свойства функции системы (не зависит от пути процесса): dQv=dU или Qv=U2-U1.
2. Изобарный процесс. Давление Р=соnst. Таким образом dQp=d(U+PV), а работа расширения равна: Ар=Р(V2-V1).
3. Изотермический процесс. Т=const, dQT=dAp=PdV Ap=RT*ln(V2/V1)=
=RT*ln(P1/P2).
4. Адиабатический процесс. dQ=0. При адиабатическом процессе работа совершается системой за счёт убыли её внутренней энергии.
Вопросы для самоконтроля:
1. Дайте определение понятию «идеальный газ».
2. Дайте определение понятию «парциальное давление».
3. Дайте определение понятию «нормальные условия».
4. Сформулируйте закон Дальтона.
5. Сформулируйте закон Бойля-Мариотта.
6. Сформулируйте закон Гей-Люссака.
7. Сформулируйте закон Шарля.
8. Сформулируйте объединенный газовый закон.
9. Сформулируйте закон Авогадро.
10. Напишите уравнение Менделеева-Клапейрона.
11. Охарактеризуйте изопроцессы, которые протекают в различных системах.