Металлы звенят – это свойство используется для изготовления колоколов, музыкальных инструментов и т.д. Cамые звонкие металлы – это золото, серебро и медь. Медь звенит густым гудящим звоном – «малиновым звоном». Малиновый звон, но не в честь ягоды - малины, а в честь голландского города Малина, из которого привозили первые церковные колокола в Россию. Потом русские мастера стали лить колокола даже лучшего качества, а жители городов и поселков жертвовали золотые и серебряные украшения, чтобы отливаемые для храмов колокола звучали лучше.
Пластичность, ковкость – это важнейшее свойство металлов изменять свою форму при ударе. Прокатываться в тонкие листы и вытягиваться в проволоку. Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи и поэтому металл характеризуется высокой пластичностью. Самым пластичным из драгоценных металлов является золото. Один его грамм можно вытянуть в проволоку длиной 2 км. (Демонстрация алюминиевой фольги). Алюминиевая фольга появилась сравнительно недавно и раньше чай, шоколад паковали в фольгу из олова.
Металлический блеск – все металлы обладают металлическим блеском. Свет поглощается поверхностью металла, и его электроны начинают испускать свои вторичные волны излучения, которые мы воспринимаем как металлический блеск. Самые блестящие металлы – это ртуть и серебро. Из ртути изготавливали в средние века знаменитые «венецианские зеркала», современные зеркала изготавливают из серебра.
Для всех металлов характерна металлическая кристаллическая решетка: в ее узлах находятся положительно заряженные ионы, а между ними свободно перемещаются электроны. Наличие последних объясняет высокую электропроводность и теплопроводность, а также способность поддаваться механической обработке.
В главной подгруппе:
- число ẽ на внешнем уровне не изменяется;
- R атома увеличивается; - электроотрицательность уменьшается;
- восстановительные свойства усиливаются;
- Ме свойства усиливаются.
В периоде:
- заряды ядер атомов увеличиваются;
- R атомов уменьшаются;
- число ẽ на внешнем слое увеличивается;
- электроотрицательность возрастает;
- восстановительные свойства уменьшаются;
- Ме свойства ослабевают.
Для атомов Ме характерны исключительно восстановительные свойства (т.е. способность отдавать ẽ и превращаться в катионы +).
Восстановительную активность Ме отражает
ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ
Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H2) Cu Hg Ag Pt Au
→ Ослабление восстановительных свойств
→ Усиление окислительных свойств
(активность Ме в водных растворах при стандартных условиях Т=250 С, Р= 1 атм)
1. Чем левее Ме, тем он более сильный восстановитель
2. Каждый Ме способен вытеснять (восстанавливать) Ме, который стоит правее (аналогично вытесняет Н из кислот)
3. Ме щелочные и щелочно-земельные в водных растворах реагируют прежде всего с водой
с кислородом активно при комнатной температуре реагируют только щелочные металлы, при этом образуются оксиды или пероксиды.

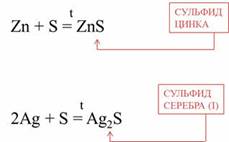
Большинство металлов, кроме Au, Pt реагируют при нагревании с серой, при этом образуются соответствующие сульфиды.
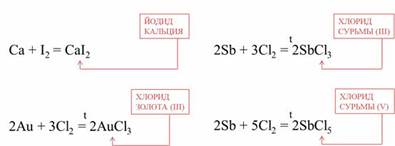
Практически все металлы реагируют с галогенами. Условия протекания этих реакций зависит от активности металла и галогена. Например, кальций реагирует с йодом при комнатной температуре, при этом образуется йодид кальция, а золото реагирует с хлором при сильном нагревании, при это образуется хлорид золота (III). Очень красиво горит сурьма в хлоре, при этом образуется смесь хлоридов: хлорид сурьмы (III) и хлорид сурьмы (V).
При нагревании металлы реагируют и с другими неметаллами. Так, в реакции алюминия с азотом, образуется нитрид алюминия, в реакции кальция с форфором, образуется фосфид кальция, в реакции алюминия с углеродом – карбид алюминия, в реакции магния с кремнием – силицид магния.

С водородом реагируют только активные металлы. Например, в реакции натрия с водородом образуется гидрид натрия.
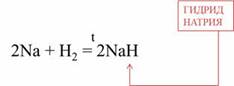
Активные металлы бурно реагируют с водой при комнатной температуре.
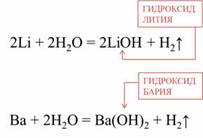
При повышенной температуре с водой реагируют и менее активные металлы.
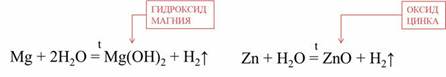
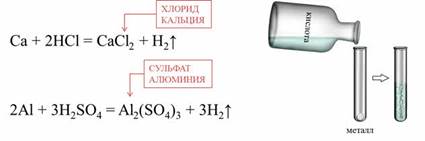
Металлы, стоящие в ряду активности до водорода, реагируют с кислотами (кроме HNO3 любой концентрации и H2SO4 концентрированной) с образованием солей и водорода.
В азотной кислоте растворяются металлы, стоящие и до, и после водорода. При этом образуются нитраты, а также различные продукты восстановления азотной кислоты.

