Алгоритм расчёта
4.1.Определение склонности пластовых вод к отложению CaSO4 (по Скиллмену-Мак-Дональду-Стиффу)
4.1.1. Дан химический состав пластовой воды в массовых концентрациях (C, мг/л): концентрации ионов Cl–, Na+, Са2+, Mg2+, НСО3–, СО32–, SO42–. Необходимо перевести данные концентрации в молярные (Cm, моль/л) следующим образом:

где С – массовые концентрации ионов, мг/л (дано),
Mr – молярная масса соответствующего иона, г/моль
1000 – перевод из мг в г.
Также данные по условию массовые концентрации ионов (C, мг/л) нужно перевести в массово-эквивалентные (Cэ, мг-экв/л) по следующей формуле:

где Mэ – эквивалентная масса соответствующего иона, Mэ = Mr/z, где z – заряд соответствующего иона.
4.1.2. Рассчитать ионную силу раствора по формуле (концентрации должны быть выражены в моль/л):

4.1.3. По таблице данного приложения найти произведение растворимости CaSO4 при интересующей температуре ПРCaSO4 (табл. 1). Для поиска полученное значение ионной силы округлить в меньшую сторону до ближайшего значения в таблице (см. пример).
4.1.4. Определить избыточную концентрацию Х осадкообразующих ионов:
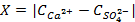 (1.4)
(1.4)
где  и
и  – концентрации ионов
– концентрации ионов 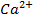 и
и  в растворе, моль/л;
в растворе, моль/л;
4.1.5. Рассчитать равновесную при данных условиях концентрацию сульфата кальция S (мг-экв/л) но формуле:

4.1.6. Фактическая концентрация сульфата кальция в растворе (СCaSO4) равна концентрации того иона (Са2+ или SO42–), который находится в растворе в меньшем количестве. Должна быть выражена в мг-экв/л.
4.1.7. Если S < CCaSO4, то данный раствор пересыщен сульфатом кальция и возможно образование осадка CaSO4.
4.2. Определение склонности пластовых вод к образованию CaCO3
4.2.1. Рассчитать ионную силу раствора I, моль/л (4.1.3)
4.2.2. Определить по таблице приложения константы уравнения Дебая-Хюккеля A и B при данной температуре (табл.2), рассчитать коэффициент активности (fCa2+ и fHCO3–) по формуле (2.1) и активности (a Ca2+ и a HCO3-) ионов Ca2+ и HCO3– по формуле (2.2), а также pa Ca2+ и pa HCO3– по формуле (2.3).

fi – коэффициент активности i-того иона,
А и В – константы, зависящие от температуры (табл.2),
ri – эффективный ионный радиус i-того иона, Å. Принять усредненный радиус 4,6 Å.

ai – активность i-того иона, моль/л

Здесь и далее знак p означает отрицательный десятичный логарифм величины, стоящей под этим знаком.
4.2.3. Рассчитать pK 2 и p ПРCaCO3 при данной температуре по формулам (2.4) и (2.5) соответственно:

K 2 – константа диссоциации угольной кислоты по второй ступени,
t – температура раствора, °С

ПРCaCO3 – произведение растворимости CaCO3
4.2.4. Рассчитать p Hs (2.6) и SICaCO3 (2.7):

p Hs – значение водородного показателя данного раствора, находящегося в равновесии с твердым CaCO3 при данных концентрациях Ca2+, HCO3– и других веществ

SICaCO3 – индекс насыщения воды карбонатом кальция (индекс Ланжелье). При SI ≤ 0 раствор не выделяет осадок малорастворимой соли, при SI > 0 осадкообразование возможно.
4.2.5. Сделать заключение о том, будет ли выпадать CaCO3 по индексу Ланжелье.
4.3. Определение склонности пластовых вод к образованию осадка FeCO3
4.3.1. Рассчитать ионную силу раствора I, моль/л (1.3)
4.3.2. Определить по таблице приложения константы уравнения Дебая-Хюккеля A и B при данной температуре (табл. 2), рассчитать коэффициент активности (fFe2+ и fHCO3–) по формуле (2.1) и активности (a Fe2+ и a HCO3-) ионов Fe2+ и HCO3– по формуле (2.2), а также pa Fe2+ и pa HCO3– по формуле (2.3).
4.3.3. Рассчитать pK 2 (2.4) и p ПРFeCO3 (3.1) при данной температуре.

ПРCaCO3 – произведение растворимости FeCO3
4.3.4. Рассчитать pHs и SIFeCO3.

pHs – значение водородного показателя данного раствора, находящегося в равновесии с твердым FeCO3 при данных концентрациях Fe2+, HCO3 и других веществ

SI – индекс насыщения воды карбонатом железа II (индекс Ланжелье). При SI ≤ 0 раствор не выделяет осадок малорастворимой соли, при SI > 0 осадкообразование возможно.
4.3.5. Сделать заключение о том, будет ли выпадать FeCO3 по индексу Ланжелье.
ПРИЛОЖЕНИЕ
Таблица 1. Произведение растворимости сульфата кальция CaSO4
| Ионная сила, моль/л | Произведение растворимости (ПРCaSO4 ·104) при температуре | |||
| 10 °С | 35 °С | 50 °С | 80 °С | |
| 0,00 | 1,02 | 1,27 | 1,25 | 0,89 |
| 0,10 | 3,04 | 3,29 | 3,31 | 2,32 |
| 0,20 | 4,99 | 5,23 | 5,28 | 4,67 |
| 0,30 | 6,87 | 7,11 | 7,17 | 6,44 |
| 0,40 | 8,68 | 8,91 | 8,96 | 8,13 |
| 0,50 | 10,41 | 10,64 | 10,68 | 9,75 |
| 0,60 | 12,07 | 12,30 | 12,30 | 11,30 |
| 0,70 | 13,65 | 13,88 | 13,85 | 12,76 |
| 0,80 | 15,16 | 15,39 | 15,32 | 14,18 |
| 0,90 | 16,60 | 16,33 | 16,71 | 15,52 |
| 1,00 | 17,96 | 18,20 | 18,02 | 16,79 |
| 1,25 | 21,05 | 21,29 | 20,96 | 19,70 |
| 1,50 | 23,69 | 23,93 | 23,46 | 22,22 |
| 1,75 | 25,90 | 26,12 | 26,52 | 24,39 |
| 2,00 | 27,67 | 27,88 | 27,18 | 26,22 |
Таблица 2. Значения констант A и B уравнения Дебая-Хюккеля (2.1) при температуре 0-100°С
| T, °С | A | B | T, °С | A | B |
| 0.4918 | 0.3248 | 0.5432 | 0.3358 | ||
| 0.4952 | 0.3256 | 0.5494 | 0.3371 | ||
| 0.4989 | 0.3264 | 0.5558 | 0.3384 | ||
| 0.5028 | 0.3273 | 0.5625 | 0.3397 | ||
| 0.5070 | 0.3282 | 0.5695 | 0.3411 | ||
| 0.5115 | 0.3291 | 0.5767 | 0.3426 | ||
| 0.5161 | 0.3301 | 0.5842 | 0.3440 | ||
| 0.5211 | 0.3312 | 0.5920 | 0.3456 | ||
| 0.5262 | 0.3323 | 0.6001 | 0.3471 | ||
| 0.5317 | 0.3334 | 0.6086 | 0.3488 | ||
| 0.5373 | 0.3346 |
Пример расчёта
Таблица 1. Исходные данные для расчёта (выделены полужирным шрифтом)
| Ион | Концентрация | ||
| мг/л | моль/л | мг-экв/л | |
| Cl– | 0,5628 | 562,817 | |
| Na+ | 0,4109 | 410,913 | |
| Ca2+ | 0,0435 | 87,000 | |
| Mg2+ | 0,0173 | 34,583 | |
| HCO3– | 0,0051 | 5,082 | |
| CO32– | 0,0000 | 0,000 | |
| SO42– | 1,2 | 0,000013 | 0,025 |
| Fe2+ | 0,000357 | 0,714 | |
| Температура | |||
| pH | 7,02 |
4.1. Определение склонности пластовых вод к образованию CaSO4
4.1.1. Заполняем таблицу 1, для этого переводим концентрации ионов в моль/л и
мг-экв/л.
Например, для иона Сl– по формуле (1.1):

По формуле (1.2):

где 35,5 г/моль – молярная масса хлорид-иона, определенная по таблице Д.И.Менделеева. В данном случае, для однозарядного иона молярная масса и эквивалентная масса совпадают (1.2).
Например, для иона SO42– по формуле (1.1):
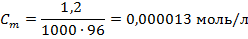
По формуле (1.2):

где 96 г/моль – молярная масса сульфат-иона, определенная по таблице Д.И.Менделеева: 32 (S) + 16∙4 (O) = 96 г/моль.
Для двухзарядного иона Mэ = 96/2 = 48.
Таким образом рассчитываем концентрации для всех ионов.
4.1.2. Рассчитываем ионную силу раствора по формуле (1.3), используя молярные концентрации:
I = (0,5628·12 + 0,4109·12 + 0,0435·22 + 0,0173·22 + 0,0051·12 + 0,000013·22 + 0,000357·22) / 2 = 0,6117 моль/л
4.1.3. По таблице 1 приложения определяем произведение растворимости CaSO4:
ПРCaSO4 = 12,3∙10-4 (значение температуры в таблице - 35°С, значение ионной силы – 0,6 моль/л – округляется в меньшую сторону от найденного. Например, если получено значение ионной силы 0,79 моль/л, округлять следует не до 0,8 моль/л по таблице, а до 0,7 моль/л).
4.1.4. Определяем избыточную концентрацию Х осадкообразующих ионов (1.4):

X = 0,0435 – 0,000013 = 0,043488 моль/л
4.1.5. Рассчитываем равновесную при данных условиях концентрацию сульфата кальция S (мг-экв/л) но формуле (1.5):


4.1.6. Фактическая концентрация сульфата кальция в растворе (СCaSO4) равна концентрации того иона (Са2+ или SO42–), который находится в растворе в меньшем количестве.
В данном случае СCaSO4 = 0,025 мг-экв/л (определяется по концентрации сульфат-иона, поскольку он в недостатке)
4.1.7. Делаем заключение о возможности выпадения осадка CaSO4:
СCaSO4 < S => CaSO4 не выпадет.
4.2. Определение склонности пластовых вод к образованию CaCO3
4.2.1 Ионная сила раствора посчитана по п.1.2 и составляет I = 0,6117 моль/л
4.2.2 Определяем константы А и В уравнения Дебая-Хюккеля по таблице 2 приложения.
А = 0,5211
В = 0,3312
Рассчитываем коэффициент активности f (2.1), активность a (2.2) и pa (2.3) ионов Ca2+ и HCO3–. Для иона Ca2+:


 =>
=> 

aCa2+ = 0,1361∙0,0435 =0,0059
paCa2+ = – lg aCa2+
paCa2+ = 2,2277
Для иона HCO3–:


aHCO3- = 0,4917∙0,0051 = 0,0025
paHCO3- = 2,6023
4.2.3. Рассчитываем pK 2 по формуле (2.4):

pK 2 = 10,2423
Рассчитываем p ПРCaCO3 по формуле (2.5):

p ПРCaCO3 = 8,5664
4.2.4. Рассчитываем pHs по (2.6):
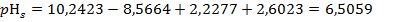

4.2.5. Рассчитываем  по формуле (2.7) и делаем заключение о возможности выпадения осадка CaCO3:
по формуле (2.7) и делаем заключение о возможности выпадения осадка CaCO3:
SICaCO3 = 7,02 – 6,51 = 0,51
SICaCO3 > 0 => возможно образование осадка CaCO3
4.3. Определение склонности пластовых вод к образованию FeCO3
4.3.1. Рассчитываемкоэффициент активности f Fe2+ (совпадает с f Сa2+, поскольку для расчета был использован средний радиус иона), активность a Fe2+ и pa Fe2+:
aFe2+ = 0,1361∙0,000357 =0,0000486
paFe2+ = 4,3134
4.3.2. Рассчитываем lg ПРFeCO3 по формуле (3.1):
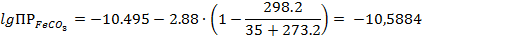
p ПРFeCO3 = 10,5884
4.3.3. Подставляем рассчитанные ранее paHCO3- (п.2.2), pK 2 (п.2.3), а также paFe2+ и p ПРFeCO3 в формулу (3.2):

4.3.4. Рассчитываем  по формуле (3.3) и делаем заключение о возможности выпадения осадка FeCO3:
по формуле (3.3) и делаем заключение о возможности выпадения осадка FeCO3:
SIFeCO3 = 7,02 – 6,6486 = 0,4504
SIFeCO3 > 0 => возможно образование осадка FeCO3