Средняя энергия молекулы
 , (2.1)
, (2.1)
где i – сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы:
 . (2.2)
. (2.2)
Внутренняя энергия для произвольной массы т газа
 . (2.3)
. (2.3)
Первое начало термодинамики
 (2.4)
(2.4)
т.е. количество тепла, сообщённое системе, идёт на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Молярная теплоёмкость при постоянном объёме
 (2.5)
(2.5)
Молярная теплоёмкость при постоянном давлении (уравнение Майера)
 (2.6)
(2.6)
Отношение теплоёмкостей  (показатель адиабаты)
(показатель адиабаты)
 (2.7)
(2.7)
Работа газа при изменении его объёма от  до
до 
 (2.8)
(2.8)
Работа газа при изобарном расширении
 (2.9)
(2.9)
Работа газа при изотермическом расширении
 (2.10)
(2.10)
Уравнения адиабатического процесса 


 (2.11)
(2.11)
Работа газа при адиабатическом расширении
 (2.12)
(2.12)
Термический коэффициент полезного действия для кругового процесса
 (2.13)
(2.13)
Термический коэффициент полезного действия цикла Карно
 (2.14)
(2.14)
Второе начало термодинамики
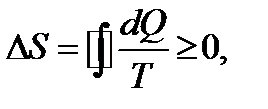 (2.15)
(2.15)
т.е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
Изменение энтропии в процессах идеального газа
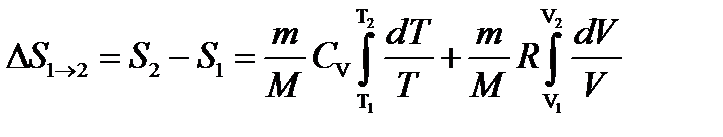
или  (2.16)
(2.16)
т.е. изменение энтропии  идеального газа при переходе его из состояния 1 в состояние 2 не зависит от вида процесса перехода 1
идеального газа при переходе его из состояния 1 в состояние 2 не зависит от вида процесса перехода 1  2.
2.
РЕАЛЬНЫЕ ГАЗЫИ ЖИДКОСТИ
Критерием различных агрегатных состояний вещества является соотношение между величинами наименьшей потенциальной энергии взаимодействия молекул  и тепловой энергии
и тепловой энергии  Наименьшая потенциальная энергия взаимодействия молекул
Наименьшая потенциальная энергия взаимодействия молекул  определяет работу, которую нужно совершить против сил притяжения для того, чтобы разъединить молекулы, находящиеся в равновесии (
определяет работу, которую нужно совершить против сил притяжения для того, чтобы разъединить молекулы, находящиеся в равновесии ( );
);  определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического движения молекул.
определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического движения молекул.
Если 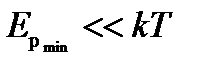 , то вещество находится в газообразном состоянии, так как интенсивное тепловое движение молекул препятствует соединению молекул, сблизившихся до расстояния
, то вещество находится в газообразном состоянии, так как интенсивное тепловое движение молекул препятствует соединению молекул, сблизившихся до расстояния  , т.е. вероятность образования агрегатов из молекул достаточно мала.
, т.е. вероятность образования агрегатов из молекул достаточно мала.
Если 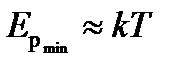 , то вещество находится в жидком состоянии, так как в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояние, превышающие
, то вещество находится в жидком состоянии, так как в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояние, превышающие  .
.
Если  , то вещество находится в твёрдом состоянии, так как молекулы, притягиваясь друг к другу, не могут удалиться на значительные расстояния и колеблются около положений равновесия, определяемого расстоянием
, то вещество находится в твёрдом состоянии, так как молекулы, притягиваясь друг к другу, не могут удалиться на значительные расстояния и колеблются около положений равновесия, определяемого расстоянием  .
.
Таким образом, любое вещество в зависимости от температуры может находиться в газообразном, жидком или твёрдом агрегатном состоянии, причём температура перехода из одного агрегатного состояния в другое зависит от значения  для данного вещества. Например, у инертных газов
для данного вещества. Например, у инертных газов  мало, а у металлов велико, поэтому при обычных (комнатных) температурах они находятся соответственно в газообразном и твёрдом состояниях.
мало, а у металлов велико, поэтому при обычных (комнатных) температурах они находятся соответственно в газообразном и твёрдом состояниях.