Диффузия - движение частиц среды, приводящее к необратимому переносу вещества или к установлению равновесного распределения концентраций частиц данного сорта в среде. В качестве диффундирующих частиц рассматривают молекулы, атомы, электроны проводимости, дырки, нейтроны и другие частицы. Диффузия в твердых веществах приводит к переносу атомов на расстояния, превышающие межатомные расстояния для данного вещества.
Частным случаем диффузии в чистом веществе или растворе постоянного состава, при котором диффундируют собственные частицы вещества, а его химический состав не меняется, является самодиффузия. При самодиффузии диффузионные перемещения частиц твердого вещества могут приводить к изменению его формы и другим явлениям. Так, длительное воздействие сил поверхностного натяжения, тяжести, упругих, электрических и др. может привести к сращиванию двух пришлифованных поверхностей образцов одного и того же вещества, спеканию порошков, растягиванию образцов под действием подвешенного к ним груза (диффузионная ползучесть материалов) и т.д.
В отсутствие макроскопического движения среды диффузия молекул (атомов) определяется их тепловым движением. При наличии в среде стационарных перепадов температуры, электрических полей и т.п. диффузия приводит к установлению равновесного распределения концентраций, характеризуемого соответствующими градиентами (термодиффузия, электродиффузия и т.п.). В однородной системе (газ, жидкость) при молекулярной диффузии в отсутствие внешних воздействий диффузионный поток (поток массы) пропорционален градиенту его концентрации. Коэффициент пропорциональности называется коэффициентом диффузии. Последний зависит от строения и структуры взаимодействующих веществ и особенно сильно - от температуры.
В твердых кристаллических веществах различают следующие виды диффузии: по механизму протекания, по геометрическому месту переноса атомов, по месту поглощения атомов и по природе процесса.
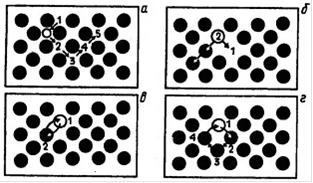
Рис. 1. Схемы механизмов протекания диффузии:
а - межузельный; б - вакансионный; в-обменный; г - циклический
Механизм протекания диффузии может быть межузелъным, вакансионным, обменным и циклическим (рис. 1). Реализация того или иного механизма протекания диффузии определяется кристаллическим строением вещества и типом дефектов его кристаллической решетки. Так, доказано, что основным механизмом диффузии примесных атомов в твердых растворах замещения является вакансионный, а в твердых растворах внедрения - межузельный.
По геометрическому месту переноса атомов выделяют объемную, поверхностную (из внешней среды) и граничную (по границам зерен) диффузии. Для совершения элементарного акта диффузии атом должен преодолеть энергетический барьер. Наиболее легко диффузия протекает по поверхности и границам зерен, где сосредоточены дефекты кристаллического строения (вакансии, дислокации и др.). Объемная диффузия в твердых веществах обусловлена перескоками атомов из одного положения в другое, относительно свободное.
Поверхностная диффузия связана с переносом вещества или на поверхность материала из внешней среды, или с поверхности материала во внешнюю среду, или на поверхность материала из его объема, или же вглубь материала с его поверхности (сорбционные процессы).
Сорбция - поглощение твердым телом или жидкостью какого-либо вещества из окружающей среды. Поглощающее тело называется сорбентом, поглощаемое - сорбтивом (сорбатом).
По месту поглощения атомов различают поверхность и объем. При этом сорбционные процессы, протекающие на поверхности, называются адсорбцией, а в объеме - абсорбцией. Сорбционные процессы избирательны и обратимы. Обратный процесс выделения поглощенного компонента называется десорбцией.
Адсорбция - поглощение вещества из газовой или жидкой среды поверхностным слоем твердого тела (адсорбента) или жидкости.
Абсорбция - поглощение какого-либо вещества из окружающей среды всей массой поглощающего тела (абсорбента). Абсорбция жидким абсорбентом какого-либо компонента из газовой смеси называется растворением, из жидкой смеси - экстракцией.
Природу диффузии по характеру сорбционных процессов рассматривают как физическую, если вещество при сорбционных процессах сохраняет все свои свойства, или химическую (хемосорбция), если вещество в этих процессах вступает в реакции. При физической природе сорбционные процессы обусловлены вандерваальсовыми силами притяжения частиц окружающей среды к частицам вещества.
Диффузионные процессы лежат в основе кристаллизации и рекристаллизации, фазовых превращений и насыщения поверхности сплавов другими элементами. С процессом диффузии связаны структурные изменения в материалах, которые могут ухудшать их физические и механические свойства.
Фазовые и структурные превращения при нагреве и охлаждении, получение того или иного структурного состояния металла и соответственно его свойства, связаны с протеканием диффузионных процессов. Даже образование при закалке мартенсита, считающееся бездиффузионным превращением, зависит от однородности твердого раствора перед закалкой, определяемого диффузией растворенных элементов.
Диффузия в значительной степени определяет кинетику физико-химических процессов, обусловливающих разрушение материалов, ползучесть, старение, коррозию и др. Так, например, адсорбция газов или жидкостей из внешней среды приводит к ухудшению диэлектрических свойств изоляционных материалов, понижает прочность металлов и изменяет другие свойства.
Очень большое значение процессы диффузии имеют при различных видах сварки. При сварке давлением в твердой фазе диффузия является основным процессом, определяющим рекристаллизацию и улучшение свойств сварного соединения после установления связи между свариваемыми активированными поверхностями. При сварке плавлением процессы диффузии влияют на степень химической и механической неоднородности металла шва и сварного соединения. Особенно большое значение процессы гетеродиффузии имеют для формирования сварных соединений разнородных сталей и разнородных металлов, так как обычные закономерности диффузионного процесса осложняются специфическими условиями диффузии - реакционной диффузией и диффузией, вызванной влиянием состава на изменение термодинамической активности растворенного и диффундирующего вещества.
2. Начертить диаграмму состояний железо-цементит, провести на ней ординату, соответствующую сплаву (1,5% С), обозначить на ней все критические точки
диффузия сплав металла
Рядом с диаграммой справа начертить кривую охлаждения данного сплава, показав связь критических точек на диаграмме и кривой охлаждения.
Описать сущность превращений, происходящих в сплаве при медленном охлаждении от температуры в жидком состоянии до комнатной. Обязательно пояснить причины, вызывающие превращения.
На ординате сплава отметить точку, соответствующую температуре 650°С, и провести через нее коноду. Пользуясь правилом отрезков, определить фазы, составляющие сплав при заданной температуре; их количество, %, и состав (содержание компонентов, %).
Диаграмма состояния Fe-Fe3C (рис. 2) характеризует фазовый состав и структуру в системе с концентрацией от чистого железа до цементита, содержащего 6,67% С. По оси абсцисс диаграмма имеет две шкалы, показывающих содержание углерода в сплаве и количество цементита. Координаты характерных точек приведены в табл. 1.
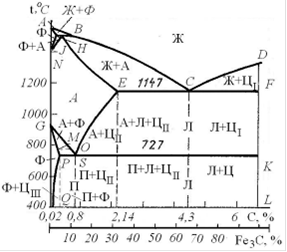
Рис. 2. Диаграмма состояния Fe-Fe3C
Таблица 1. Характерные точки диаграммы состояния железо-цементит
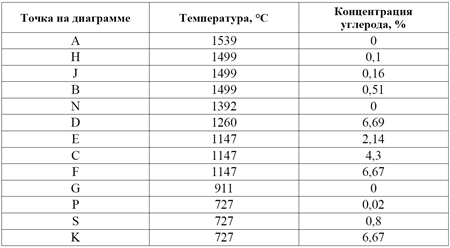
Точки А и D характеризуют температуру плавления железа и цементита соответственно. Точки N и G - температуры полиморфных превращений железа. Точки Н и Р характеризуют максимальную растворимость углерода в ОЦК решетке железа в высокотемпературной и низкотемпературной областях. Точка Е определяет максимальную растворимость углерода в железе с ГЦК решеткой. Фазовые превращения в системе Fe-Fe3C происходят как при затвердевании из жидкого агрегатного состояния, так и в твердом агрегатном состоянии. Первичная кристаллизация идет в областях между линиями ликвидус (ABCD) и солидус (AHJECF). Вторичная кристаллизация в твердом агрегатном состоянии является следствием полиморфного превращения железа и изменения растворимости углерода в железе с изменением температуры.
На линии ликвидус начинается кристаллизация из расплава соответственно на участке АВ - феррита (δФ), на участке ВС - аустенита (А) и на участке СD - цементита первичного (ЦI). На линиях АН и JЕ завершается кристаллизация δФ и аустенита из жидкой фазы. Для диаграммы Fe-Fe3C характерны три изотермических превращения:
перитектическое на линии HJВ при температуре 1499°С
Ф Н + Ж B  А J;
А J;
- эвтектическое на линии ECF при температуре 1147°С
Ж C  А E + Ц F;
А E + Ц F;
эвтектоидное на линии PSK при температуре 727°С
А S  Ф P + Ц K.
Ф P + Ц K.
Эвтектическая смесь аустенита и цементита называется ледебуритом (Л), а эвтектоидная смесь феррита и цементита вторичного - перлитом (П). Ледебурит и перлит рассматривают как самостоятельные структурные составляющие. Перлит чаще всего имеет пластинчатое строение и обладает высокими механическими свойствами: sв = 800…900 МПа, s0,2 = 450 МПа, δ £ 16%, твердость НВ 180…220.
Ледебурит имеет сотовое или пластинчатое строение. Сотовая структура образуется при медленном охлаждении и представляет собой пластины цементита, переплетенные кристаллами аустенита. Большое количество цементита, присутствующего в ледебурите, обеспечивает его большую твердость, порядка 600 НВ, и хрупкость, что затрудняет механическую обработку сплавов с ледебуритной структурой.
Стали в зависимости от содержания углерода подразделяются на эвтектоидные, содержащие ~ 0,8% С, доэвтектоидные (от 0,02 до 0,8% С) и заэвтектоидные (более 0,8 и до 2,14% С).
Вычертим кривую охлаждения заэвтектоидного сплава 1,5% С, рис. 3:
Такой сплав называется заэвтектоидной сталью (>0,8% С), ниже 727°С будет иметь следующую перлитно-цементитную структуру.
Рис. 3 иллюстрирует охлаждение заэвтектоидной стали.
Основные фазы диаграммы:
– жидкость - жидкий раствор углерода в железе;
– аустенит - твердый раствор углерода в γ-железе;
– феррит - твердый раствор углерода в α-железе;
– цементит - химическое соединение железа и углерода Fе3С;
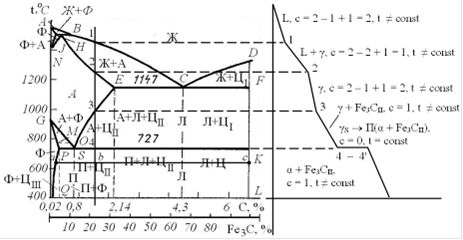
Рис. 3. Диаграмма железо-цементит (слева), кривая охлаждения для сплава, содержащего 1,5% углерода (справа)
Выше точки 1 сплав находится в жидкой фазе (жидкий расплав углерода и Fe, фаза L), число степеней свободы - С = 2 - 1 + 1 = 2 (температура может изменяться).
При достижении точки 1 в жидкости начинается первичная кристаллизация аустенита. Ниже точки 1 и выше точки 2 сплав имеет двухфазное состояние: жидкость и кристаллы аустенита (Ж → Ж + А, С = 2 - 2 + 1 = 1, температура может меняться). Состав кристаллов меняется по линии солидус JE, а жидкой фазы по линии ликвидус BC.
Ниже линии солидус точки 2 сплав находится в твердом однофазном состоянии твердого раствора (аустенит). При дальнейшем охлаждении (2 → 3) аустенит просто остывает, не меняя состава.
В т. 3 из аустенита начинает кристаллизоваться вторичный цементит. По мере понижения температуры состав аустенита изменяется по линии ES. В т. 4 (7270С) имеем цементит (6,67% С) и аустенит, содержаний 0,8% углерода, распадающийся на перлит (С = 2 - 3 + 1 = 0, температура не меняется до полного превращения, горизонт 4-4').
Ниже 7270С структура перлит + вторичный цементит.
Нанесем на диаграмму коноду abc, соответствующую температуре 650°С и определим при этой температуре количественное соотношение фаз и процентное содержание углерода в этих фазах.
Процентное содержание углерода в феррите определяем при помощи точки а коноды abc: 0,015% С. Процентное содержание углерода в цементите определяем при помощи точки с коноды abc: 6,67% С.
Тогда количество феррита:α = bc/ac ∙ 100% = (6,67 - 1,5) / (6,67 - 0,015) ∙ 100% ≈ 78%
Количество цементита:Fe3C = 100 - 78% = 22%
Соотношение фаз: QFe3C: Qα = 1: 3,54.
Список литературы
1. Лахтин, Ю.М. Материаловедение / Ю.М. Лахтин, В.П. Леонтьева. - Москва: Машиностроение, 1990. - 528 с.
2. Металловедение и технология металлов: учеб. для вузов / Ю.П. Солнцев [и др.]. - Москва: Металлургия, 1988. - 512 с.
. Материаловедение: учеб. для вузов / Б.Н. Арзамасов [и др.] под ред. Б.Н. Арзамасова. - 2-е изд. - Москва: Машиностроение, 1986. - 383 с.
. Материаловедение / Б.Н. Арзамасов [и др.]. - 7 изд. - Москва: Изд-во МГТУ им. Н.Э. Баумана, 2005. - 648 с.
. Материаловедение: учебник / В.А. Струк [и др.]. - Минск: ИВЦ Минфина, 2008. - 519 с.
. Сидорин И.И. Косолапов Г.Ф. Материаловедение: Учебник для высших технических учебных заведений. 2006 - 215 с.
. Солнцев Ю.П., Пряхин Е.И. Материаловедение. 2006 - 263 с.