Химический факультет
РЕФЕРАТ
Современные модели описания структуры жидкости
Ассоциаты и кластеры в жидкостях
Выполнила студентка 691 группы Величкина Юлия
Барнаул 2002
Введение
Жидкое состояние вещества является промежуточным между твердым и газообразным. Область существования жидкости ограничена со стороны низких температур переходят в твердое состояние высоких – переходом в газообразное. Для каждого вещества существует температура, называемая критической Ткр , выше которой жидкость не может находится в равновесии с собственным паром.
Жидкости сохраняют отдельные свойства как твердых тел, так и газов.
Твердые тела по характеру расположения атомов или молекул подразделяются на кристаллические и аморфные. Кристаллы обладают ближним и дальним порядком.
Частицы кристалла расположены так, что расстояние между сколь угодно удаленными частицами непосредственно выражается через кратчайшее расстояние между двумя соседними частицами. По типам связи кристаллы подразделяются на атомные, ионные, молекулярные и металлические. Кристаллические тела обычно анизотропны, их механические, тепловые, электрические и оптические свойства в разных направлениях неодинаковы. Одно и то же кристаллическое вещество может находиться в нескольких модификациях, обладающих неодинаковой структурой. Так, углерод существует в виде графита и алмаза; двуокись кремния SiO2—в виде кварца, тридимита и кристаболита; сера — в виде ромбической и моноклинной модификации. Атомы, ионы или молекулы, образующие кристалл, совершают согласованные (коллективные) колебательные движения, энергия их сцепления больше внутренней энергии кристалла.
В газообразном состоянии вещества атомы или молекулы взаимодействуют друг с другом посредством ван-дер-ваальсовых сил притяжения на больших, по сравнению с размерами частиц, расстояниях, и квантово-механических сил отталкивания на малых расстояниях. Однако силы притяжения не достаточны, чтобы удержать молекулы друг возле друга, вследствие чего их взаимное расположение в газе хаотическое. Молекулы газа находятся в беспрерывном движении, которое происходит в виде поступательных, несогласованных (индивидуальных) перемещений и столкновений в конце каждого свободного пробега. Кинетическая энергия молекул газа значительно больше потенциальной. В многоатомных молекулах наряду с поступательным движением может происходить вращение молекулы как целого и колебания составляющих ее атомов.
Жидкость, как и твердое тело, — система динамическая. Атомы, ионы или молекулы, сохраняя ближний порядок во взаимном расположении, участвуют в тепловом движении, характер которого гораздо более сложный, чем в кристаллах. Молекулы жидкостей совершают колебания такого же типа, как и в кристаллах, но положения равновесия, относительно которых происходят эти колебания, не остаются неподвижными. Совершив определенное число колебаний около одного положения равновесия, молекула скачком переходит в новое положение и продолжает там колебаться вплоть до следующего скачка. Посредством таких скачкообразных перемещений молекул в жидкостях осуществляется диффузия, которую, в отличие от непрерывной, называют диффузией скачком.

Рис. 1. Диаграмма состояния однокомпонентного вещества.
Согласно Я. И. Френкелю, длительность пребывания молекулы во временном положении равновесия — время оседлой жизни — определяется по формуле
t=t0еw/kТ (1.1)
где t0 — период колебаний молекул около положения равновесия; W — высота потенциального барьера, который отделяет друг от друга два соседних положения равновесия; k— постоянная Больцмана; Т — абсолютная температура. Численное значение t зависит от строения и вязкости жидкости. Для воды при комнатной температуре to=l,4-10 -12 с. Следовательно, каждая молекула воды совершает около 100 колебаний относительно одного и того же положения равновесия, прежде чем переменить место. По образному выражению Френкеля, молекулы в жидкости ведут в основном оседлый образ жизни, что представляет собой характерную черту жидкого состояния, сближающего его с твердым телом, с той разницей, что в твердых телах время оседлой жизни гораздо больше, чем в жидких.
С ростом температуры время оседлой жизни молекул во временном положении равновесия уменьшается. Соответственно усиливается трансляционное движение молекул.
Многочисленные исследования показывают, что наряду с колебанием молекул в окружении своих соседей и активационными скачками в жидкостях происходят плавные перемещения молекул вместе с их ближайшим окружением. Иными словами, находящиеся в колебательном состоянии молекулы жидкости в каждый момент времени смещаются на некоторое расстояние (меньше межатомного), обусловливая непрерывную диффузию. Можно полагать, что в сжиженных инертных газах и металлах преобладает непрерывная диффузия, тогда как для ассоциированных жидкостей (например, для воды) более вероятен прыжковый механизм диффузии.
В жидком состоянии вещества в отличие от газообразного проявляются те же межмолекулярные силы притяжения, которые обусловливают тот или иной тип связи в кристалле. Так, например, между атомами сжиженных инертных газов действуют дисперсионные ван-дер-ваальсовы силы. Те же силы обусловливают взаимное притяжение молекул диэлектрических жидкостей (бензол, парафины и др.). Между молекулами воды, спиртов, кислот жирного ряда действуют специфические силы притяжения, возникновение которых связано с наличием в составе этих молекул группы ОН (водородная связь). В расплавах солей действуют электростатические силы, в металлах — силы металлической связи. В жидком германии, кремнии и других полупроводниковых веществах наряду с металлической связью частично сохраняется ковалентная связь. Жидкости, принадлежащие к данному типу межмолекулярных связей, характеризуются специфическим ближним порядком в расположении частиц, что отражается на поведении физических свойств вещества в жидком состоянии. В естественных условиях жидкости изотропны, имеют только одну модификацию. Исключением является гелий, который может находиться в двух фазах, и так называемые жидкие кристаллы, у которых существует как изотропная, так и анизотропная фазы.
Из изложенного следует, что жидкости по характеру взаимного расположения частиц, их динамике и взаимодействию ближе к кристаллическому, а не к газовому состоянию вещества. Полная энергия молекул жидкости равна сумме их кинетической и потенциальной энергий. Соотношение между их численными значениями зависит от температуры и давления. Являясь фазой, промежуточной между твердой и газообразной, жидкость, естественно, обнаруживает непрерывную гамму переходных свойств, примыкая в области высоких температур и больших удельных объемов к газам, а в области низких температур и малых удельных объемов - к твердым телам
Глава 1. Структура жидкостей
Структура жидкостей – это способ распределения ее частиц в пространстве. Если взаимное расположение молекул, атомов или ионов, входящих в состав жидкости, изучено, то ее структура считается известной. Экспериментальным методом исследования структуры является рентгенография.
Трактовать структуру жидкости можно на основе существующих молекулярных моделей.
1.1. Микрокристаллическая модель
Микрокристаллическая модель предполагает, что в жидкости существуют группы молекул – ''микрокристаллы'', содержащие несколько десятков или сот молекул. Внутри каждого микрокристалла сохраняется в точности порядок твердого тела. Эти группы молекул, или ''кластеры'', существуют непродолжительное время, затем распадаются и создаются вновь; кроме того, они постоянно перемещаются так, что каждая молекула не принадлежит все время к одной и той же группе молекул или ''кластеру''. Собственно этим свойством объясняется текучесть жидкости. Наличие в жидкости пространственного упорядочения молекул подтверждается многими факторами, в частности экспериментальными по рассеянию света и рентгеновского излучения, нейтронов и электронов.
Результаты рентгеновского анализа жидкостей можно объяснить, представив их структуру либо как скопления множества ультрамикроскопических значительно деформированных агрегатов, либо в виде непрерывной, структурной сетки, в которой элементы структурного порядка ограничены ближайшими соседями.
Первое предположение означает, что огромное число мельчайших ''кристаллических островков'' (сиботоксических групп) разделены областями беспорядоченного расположения частиц. Эти группы не имеют резких границ, плавно переходя в области неупорядоченного расположения частиц. Они перемещаются и не только непрерывно утрачивают одни частицы и пополняются другими, но могут разрушаться и создаваться вновь. Как в газе, они перемещаются по объему, как в кристаллах, колеблются около положения равновесия. Нагревание сокращает время ''оседлой'' жизни сиботаксических групп, охлаждение приводит к противоположному результату. Таким образом, представление о жидкости формируется на основании результатов синтеза представлений о газах и кристаллах – сочетания закономерного расположения молекул в небольших объемах с неупорядоченным распределением во всем объеме.
1.2. Квазикристаллическая модель.
Квазикристаллическая модель предполагает, что относительное расположение частиц в жидкости приближается к имеющемуся в кристалле, причем отступление от правильности систематически увеличивается с расстоянием по мере удаления от исходной молекулы на большом расстоянии уже не наблюдается правильности в расположении молекул, то есть в жидкости имеет место ''ближний порядок'' и отсутствует ''дальний порядок''.
Второе предположение сводится к представлению о квазикристаллической структуре жидкости: каждая молекула окружена соседними, которые располагаются вокруг нее почти так же, как и в кристалле того же вещества. Однако во втором слое появляются отклонения от упорядоченности, которые увеличиваются по мере отдаления от первоначально взятой молекулы. Иначе говоря, отступление от правильного расположения по мере удаления от данной молекулы систематически возрастает и на большом расстоянии становится очень значительным – в жидкости существует ближний порядок. Этим строение жидкости отличается от строения кристаллов, характеризующегося строгой повторяемостью одного и того же элемента структуры (иона, атома, группы атомов, молекул) во всех направлениях, то есть дальним порядком.
Изучение рассеяния рентгеновских лучей в жидкостях, состоящих из многоатомных молекул, показало не только упорядоченное расположение молекул, но и известную закономерность во взаимной ориентации частиц. Эта ориентация усиливается для полярных молекул и если проявляется действие водородной связи.
Беспорядочное движение молекул жидкости приводит к непрерывному изменению расстояний между ними. Это можно выразить словами: структура жидкости носит статистический характер. В этом состоит существенное различие жидкости от кристаллов. Статистический характер упорядоченного расположения молекул жидкости приводит к флуктуациям – непрерывно происходящим отклонениям не только от средней плотности, но и от средней ориентации, так как молекулы жидкости способны образовывать группы, в которых преобладает определенная ориентация. Чем меньше величина этих отклонений, тем чаще они встречаются.
1.3. Колебательно - усредненная структура жидкости
Структурное описание может относиться ко всему множеству элементов атомно-молекулярной системы, задающемуся числом частиц, или к его части. Полное соответствие соблюдается только в случае идеального кристалла, однако оно не является единственно возможным в частично упорядоченных системах (фазах), имеющих внешние и внутренние поверхности раздела. Второе разделение связано с тем, что структура может относиться не только к исходным элементам множества, задающего систему, но и к производным элементам, геометрически или топологически задающимся в пространстве (например, разного рода полиэдральные схемы для всего объема жидкости). Разновременные I, V, D и производные от них структуры в твердом и жидком состоянии, связанные с усреднениями в расположении частиц за разные времена, привносят добавочную специфику и представляют характерный пример отличия структурных элементов в параллельно сосуществующих структурах.
С использованием компьютерного эксперимента и других теоретических и экспериментальных методов в жидкости в настоящее время выделяются разные пространственные структуры.
В структуре I структурные единицы тождественны или задаются исходными точками (частицами) системы, которые могут быть получены методами компьютерного моделирования.
В структуре V исходный структурный элемент выделяется при усреднениях расположений частиц при их колебательных движениях. При этом, в случае кристалла появляется трансляционная упорядоченность в цепочке частиц.
Наиболее вероятная структура Dv, в этом случае геометрически тождественна со структурой V. В то же время только в случае структуры D реального кристалла, реализующейся за макроскопические времена, появляется решетка кристалла и возможность описания системы, используя федоровские группы симметрии (при отсутствии рассмотрения внешних границ). Таким образом, понятие идеального кристалла может соотноситься в первую очередь со структурой D реального объекта. В то же время объединение динамического и геометрического подходов описания структуры кристаллов, по-видимому, возможно через анализ соотношения их конкретных структур I, V, Dv, D.
При переходе к жидкости появляются новые структурные особенности. Описание структуры здесь должно быть дано в уточняющей трактовке, не тождественной квазикристаллическому описанию. Это связано с тем, что в отличие от твердого тела колебательно - усредненную структуру жидкости нельзя рассматривать без учета влияния диффузионных (трансляционных и вращательных) движений молекул на характер усреднения их центров колебаний, задающих геометрию структурных единиц. Особенность рассматриваемой здесь V -структуры заключается в том, что она относится к пространственно - разделенным участкам системы, включающим только часть ее частиц, и отвечает дискретному расположению центров колебаний (или усредненных позиций среди смещающихся центров колебаний) вокруг позиции, задающейся невозмущенной диффузионным движением конфигурацией молекул. Геометрические различия структур V и V ' соответствуют различиям ''жестких'' и ''мягких'' структурных конфигураций в конформационном анализе. При совместном рассмотрении жестких и нежестких структур V и V' жидкостей и растворов и жестких (мягких) конфигураций сложных молекул может идти объединение геометрического и динамического подходов к анализу структуры сложных систем и изучение структурных эффектов влияния среды на конформационные движения молекул. Переход к описанию жидкости на уровне колебательно - усредненной структуры в этом случае может осуществляться в рамках рассмотрения двух структурных подсистем (V и V') с учетом трех видов молекул, которые могут в разной степени присутствовать в жидкостях:
V -частицы, которые осуществляют колебательные движения во временных положениях равновесия в течение времени τ в постоянном поле, создаваемом одними и теми же соседями (центр колебаний центральной молекулы усредняется вне влияния поля нарушений, появляющегося вследствие изменения расположений частиц при диффузионных движениях).
I' -частицы, находящиеся вне позиций, отвечающих временным положениям равновесия в конфигурациях глубоких минимумов, на поверхности потенциальной энергии системы.
V' -частицы, колебания которых осуществляются при наличии влияния быстропеременного поля локальных нарушений исходной постройки, создаваемого I' -частицами.
1.4. Кластерная структура жидкости.
Кластеры, многоядерные комплексные соединения, в основе молекулярной структуры которых лежит объемный скелет (ячейка) из атомов металла, (обычно переходного), непосредственно связанных между собой. Ячейка окружена лигандами и играет роль центра атома. Как правило, она имеет, форму правильного полиэдра. Из возможных полиэдров чаще других реализуются те, стороны которых правильные треугольники.
Атомные и молекулярные кластеры. В простейшем случае эту систему описывают моделями, в которых частицы заменены шарами. При этом кластер удобно рассматривать как жидкую каплю, в которой частицы плотно упакованы. На рис. 2 показан пример такого кластера. С геометрической точки зрения такая модель кластера не представляет наиболее плотную упаковку шаров. Под плотностью упаковки обычно понимают долю пространства занимаемую шарами, которыми заполнено все пространство. Так, например, пентагональная упаковка шаров, изображенная на рис. 3, является более плотной, чем рассматриваемая нами модель (ее плотность составляет 72 процента).


Рис. 2.Шаровая модель кластера. Рис. 3.Пентагональная упаковка шаров.
При конечной температуре такая упаковка, однако, обладала бы большей свободной энергией, чем рассматриваемая нами модель жидкой капли. Возможны и более плотные упаковки шаров, чем изображенная на рис. 3. Существует две основные плотнейшие упаковки — кубическая трехслойная и гексагональная двухслойная. Для плотнейшей упаковки коэффициент заполнения пространства равен 0.74048. Такие структуры действительно могут наблюдаться при очень низких температурах в кластерах из атомов благородных газов.
Современная технология позволяет получать кластеры, содержащие заданное число молекул данного типа. Методом масс - спектрометрии можно выбрать из пучка кластеры, содержащие фиксированное число молекул п. Так у плотно упакованного кластера из 20 атомов только один атом находится внутри объема. У кластеров из 100 атомов — не более 20.
Для малых кластеров n < 100 необходимо детальное знание структуры кластера. В некоторых случаях, однако, рассматриваемая нами модель жидкой капли для описания свойств кластера имеет смысл, даже если число атомов в кластере очень мало. Это можно проиллюстрировать на примере кластеров, образующих изомеры — различные молекулярные конфигурации данного химического соединения. Каждый изомер локально устойчив, поскольку соответствует минимальной энергии, однако он может перейти в другую изомерную форму, если при нагревании получит достаточно энергии. Один из примеров таких «текучих» кластеров — тример натрия: три атома образуют равнобедренный треугольник, у которого угол, образованный двумя одинаковыми сторонами, не остается в каком-то одном положении, а непрерывно перемещается с одной вершины на другую. Поскольку на микроскопическом уровне их форма не фиксирована, текучие кластеры следует рассматривать в этом случае скорее как капли жидкости, а не как твердые частицы.
Кластеры из атомов инертных газов представляют собой простейший и наиболее изученный тип кластеров.

Рис.5.Кластер аргона.
На рис. 5 приведено изображение кластера из атомов аргона, содержащего 16 атомов. Атомы инертных газов с полностью заполненными электронными оболочками слабо взаимодействуют друг с другом посредством ван-дер-ваальсовых сил.
Характерная энергия связи, т.е. энергия, затрачиваемая на отрыв атома от кластера, очень мала и составляет примерно 10 К - 100 К. При описании таких кластеров с достаточно хорошей точностью применима модель твердых шаров. В настоящее время с помощью описанной выше технологии газопламенных кластерных пучков удается создавать кластеры из атомов инертных газов, содержащие от нескольких единиц до десятков тысяч атомов. Кластеры из атомов инертных газов представляют собой уникальный объект для изучения атом-атомных взаимодействий различных типов возбуждений в таких кластерах, электрон-атомного взаимодействия и т.д.
Глава 2. Ассоциаты в жидкостях
Ассоциаты – это неустойчивые группы (димеры, тримеры), в которых молекулы связаны ван–дер–ваальсовыми, диполь–дипольными и другими силами, взаимодействиями с переносом заряда, включая водородную связь.
Существует три способа приближенного описания строения жидкостей. Один из них опирается на представление об ассоциатах и комплексах, другой связан с понятием о функциях распределения частиц, третий использует понятия о флуктуациях. Поскольку строение жидкостей определятся короткодействующими химическими силами, то и корреляция, то есть взаимосвязь положений молекул, также должна зависеть, в основном, от короткодействующих сил химического типа. Эти силы определяют вероятные положения молекул первой координационной сферы. От этих сил зависят вероятные положения молекул второй координационной сферы по отношению к молекулам сферы и так далее. Таким образом, корреляция есть статистическое описание ассоциации и комплексообразования. Функции распределения положений частиц, описывающие корреляцию молекул или атомов, имеют статистическую природу. Связь между функциями распределения и межмолекулярными взаимодействиями, а также строением ассоциатов и комплексов сложна и неоднозначна. Известен ряд приближенных аналитических выражений этой связи, которые, как правило, основаны на предположении, что молекулы представляют собой шарики. Потенциал взаимодействия молекул обычно подбирается с помощью эмпирических соотношений, например, уравнения Леннарда – Джонса. Этот подход получил наибольшее распространение при описании строения одноатомных жидкостей, таких, как жидкий аргон.
Наибольший интерес представляют те сведения о функциях распределения, которые могут быть получены на основе анализа экспериментальных данных, то есть независимо от модели системы. Основным источником такой информации для жидкостей служат рассеяние рентгеновских лучей или нейтронов. Каждый из этих методов позволяет получить сведения о радиальной функции распределения g(R).
К сожалению, g(R) малочувствительна даже к существенным изменениям не только дальнодействующей, но и близкодействующей части потенциометрической энергии межмолекулярных сил.
Метод функций распределения в настоящее время не дает возможности исследовать механизмы быстрых процессов, протекающих в жидких фазах. Наиболее перспективен в этом отношении способ описания структуры жидкостей с помощью понятий об ассоциатах и комплексах.
Каждую жидкую фазу можно считать гигантской макромолекулой. В таких огромных макромолекулах встречаются однотипные, малые фрагменты, содержащие небольшое число атомных ядер, взаимное расположение которых более или менее фиксировано. Эти фрагменты – упорядоченные образования, возникающие в результате химического взаимодействия между частицами, называются молекулами, их ассоциатами и комплексами. Ассоциаты и комплексы – однотипные образования и различаются только своим составом. Ассоциатами называются такие упорядоченные образования, которые состоят из одинаковых молекул (мономерных звеньев). Таков ассоциат (H2O)p, в котором имеется р молекул воды, ассоциат метилового спирта (СН3ОН)n и так далее. Комплексы отличаются от ассоциатов тем, что состоят из разнородных молекул.
Для характеристики ассоциатов необходимо знать их состав, структуру, а также энергии химических связей между частицами (молекулами, атомами, ионами), образующими ассоциат. Когда состав и структура ассоциатов установлена, нужно найти их концентрации. Как правило, в чистых жидкостях имеется множество различных ассоциатов, а в растворах кроме ассоциатов присутствует очень много разнообразных комплексов. Полное описание всех видов и форм ассоциатов, которые могут быть в какой – либо жидкой фазе, не может быть достигнуто ни одним из современных методов исследования или их сочетанием. Но можно определить основные, типические ассоциаты, наиболее часто встречающиеся в данной жидкости, и поэтому в первом приближении, характеризующие ее строение. Такая характеристика будет приближенной. Положительная сторона ее состоит в наглядности, возможности проверки несколькими независимыми методами, а, главное, в способности предсказывать свойства жидких фаз и изучать молекулярные механизмы тех процессов, которые протекают в жидкостях. Рассмотрим пример – описание структуры жидких одноатомных алканолов RОН.
Молекулы жидких алканолов могут образовывать друг с другом связи вида: О – Н … О, С – Н…О и С – Н…С. Ограничимся характеристикой тех ассоциатов, которые возникают за счет более прочных связей О – Н…О.
Атом кислорода в молекуле RОН имеет две не поделенные пары электронов и может принимать участие не более, чем в двух связях О – Н…О. В результате могут образовываться цепочечные и кольцевые ассоциаты, разветвленные и неразветвленные. Приведем примеры.
Цепочечные неразветвленные ассоциаты.
В неразветвленных цепочечных ассоциатах (RОН)p каждый атом кислорода участвует только в одной Н – связи. Цепочка может состоять из 2,3,4,…, р молекул RОН. Число р в принципе не ограничено. Ассоциаты могут иметь различные конформации за счет ''внутреннего вращения'' вокруг связей О – Н…О. Переход от одной конформации к другой в ходе теплового движения молекул в данном случае происходит, как правило, с разрывом Н – связей, следовательно, не так, как в полиэтилене и других полимерах, образованных за счет сильных химических связей. Но итог одинаков – наряду с трансконформацией ассоциата существует множество свернутых конформаций.
Цепочечные разветвленные ассоциаты алканолов (ROH)p
Присутствие второй, не поделенной пары электронов у атомов кислорода в спиртах, может приводить к возникновению разветвленных ассоциатов. Эти ассоциаты имеют большее число свободных концевых групп ОН, равное числу ответвлений в цепочке. Те кислородные атомы, которые одновременно участвуют в двух водородных связях, что и приводит к разветвлению цепочки, сохраняют способность выполнять ''шарнирные скачки'', сопровождающиеся изменением ориентации соответствующей группы OR. Но в отличие от неразветвленных участков здесь ''шарнирный переход'' требует одновременного разрыва двух Н – связей и после восстановления одной из них сопровождается исчезновением разветвления. Такие переходы приводят к частичному распаду разветвленного ассоциата и потому не входят в группу конформационных превращений.
Кольцевые ассоциаты могут быть неразветвленными и разветвленными. Неразветвленные кольцевые ассоциаты (ROH)p не имеют свободных гидроксильных групп.
Разветвленные кольцевые ассоциаты при большом числе ответвлений от кольца могут образовывать кустовые ассоциаты.
В любом жидком одноатомном алканоле могут присутствовать все перечисленные ассоциаты, возникающие за счет связей О – Н…О. Кроме того, существует множество менее устойчивых ассоциатов, образованных с помощью связей С – Н…О и С – Н…С.
Наиболее доступны исследованию ассоциаты, удовлетворяющие следующим условиям. Связи, благодаря которым они возникают, более прочны, чем все другие типы связей между молекулами, возможные в данной жидкой фазе. Так, в спиртах связи О – Н…О значительно прочнее, чем связи С – Н…О и C - Н…С. Присутствие более слабых связей на фоне относительно сильных связей обычно остается незамеченным.
Исследование ассоциатов существенно облегчается, если их строение простое, а другие структуры за счет тех же связей отсутствуют или же играют второстепенную роль. В нормальных одноатомных алканолах ROH основной тип ассоциатов – неразветвленные цепочки. Другие типы ассоциатов за счет связей О – Н…О могут быть, но их концентрация мала, их влиянием на свойства алканолов при современной точности эксперимента можно пренебречь.
Принципиальные трудности возникают, когда речь идет об ассоциатах, представляющих собой двух или трехмерные сетки, похожие на те, которые наблюдаются в стеклах. Само понятие об ассоциатах как фрагментах макромолекул в этом случае теряет смысл, потому что пространственная сетка, в сущности, не имеет границ. Выделение в пространственной сетке отдельных фрагментов и описание их как относительно независимых конструкций представляет собой более грубое приближение, чем в тех случаях, когда можно отвлечься от существования сетчатых структур.
В любой жидкой фазе пространственные сетки молекул существуют всегда. Каждый образец жидкости – гигантская макромолекула. Речь идет о возможности приближенного подразделения пространственных структур на относительно независимые простые фрагменты. Наконец, изучение ассоциатов становится на много более сложным, если молекулы могут образовывать друг с другом несколько одинаковых связей, например С – Н…С, приобретая при этом разные взаимные ориентации. Если вероятность возникновения димеров, тримеров и так далее со многими различными взаимными ориентациями мономерных звеньев приблизительно одинакова, то подобные ассоциаты для большинства современных методов исследования выглядят как хаотические, бесструктурные, неупорядоченные, неассоциированные системы. Именно эта особенность объясняет то, что ассоциация четыреххлористого углерода, алканов и некоторых других жидкостей до недавних пор не обнаруживалась.
Глава 3. Кластеры в жидкостях
Для описания жидкого состояния наиболее полную картину кластерной динамики предложил Стюарт. По Стюарту, жидкость состоит из очень маленьких кристаллов (сиботаксических групп), представляющих собой агрегат из нескольких десятков или сотен молекул, которые неустойчивы и непрерывно меняют свое положение. Комплексы распадаются и образуются вновь так, что вполне определенная молекула непрерывно меняет группы и входит в состав все новых и новых конгломератов. Сиботаксические группы Стюарт рассматривал, как не резко очерченные области, переходящие непрерывным образом одна в другую. В пределах сиботаксических областей относительное расположение частиц и их относительная ориентация сохраняют достаточную степень правильности. К этому же времени относятся работы Данилова по рентгеноструктурному исследованию жидкостей, который доказал наличие в них ближнего порядка.
Не подвергал сомнению реальное существование кластеров Френкель. Он полагал, что у веществ с вытянутой стержнеобразной формой между кристаллическим и обычным жидким состояниями наблюдается промежуточное жидкокристаллическое или анизотропно – жидкое состояние. При этом ориентационный порядок сохраняется в макроскопически малых областях, которые, по Орнштейну, называются роями. Ориентационно - упорядоченные области, но значительно меньших размеров, существуют в обычном аморфно – жидком состоянии, которые Стюарт обозначил как сиботаксические области. В случае анизотропных жидкостей рои при отсутствии внешних воздействий сохраняют неизменную структуру, то есть представляют собой термодинамически устойчивые образования. Сиботаксические области отличаются от роев не только своими малыми размерами, но и флуктуационным характером образования и распада. Такого же мнения придерживается Уббелоде, который определил рои как кристаллизуемые кластеры и сиботаксические группы как антикристаллические кластеры.
Кластеры устойчивы и могут находиться длительное время в изолированном состоянии. Есть основания полагать, что заряженные частицы стабилизируют кластеры. Поэтому можно подразделить кластеры на заряженные и не имеющие заряда – нейтральные кластеры.
Процессы взаимодействия кластеров настолько деликатны, что зачастую не поддаются прямым измерениям. Любое воздействие на кластер в большинстве случаев должно приводить к его разрушению.
3.1. Поляронные состояния в нейтральных кластерах
Исследование электронных свойств нейтральных кластеров из поляронных молекул были начаты сравнительно недавно, лишь в начале 1990-х годов. Вначале были исследованы металлосодержащие кластеры воды и аммиака. Потенциал ионизации металламиачных кластеров имеет обычную асимптотическую зависимость, которая подтверждается различными теоретическими исследованиями. По сравнению с аммиачными кластерами, комплексы из атомов металла и молекул воды проявляют аномальные свойства: в частности, при большом числе полярных молекул потенциал ионизации не зависит от размера кластера. Для объяснения этих аномалий может быть использована континуальная модель.
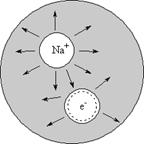
Континуальная модель. Для того чтобы качественно проанализировать ситуацию в случае нейтральных кластеров, рассмотрим простейшую континуальную модель, где вместо электрона в кластере помещен атом металла. Поскольку в качестве металла обычно используются щелочные атомы, валентный электрон которых слабо связан с атомом, такой кластер можно рассматривать как непрерывную полярную среду, заполняющую сферу радиуса R, которая содержит электрон и ион атома металла. Взаимодействие между ионом и валентным электроном включает в себя не только кулоновский потенциал, но и поляризацию, создаваемую полярными молекулами кластера. Вклад поляризации можно описывать с помощью двух диэлектрических проницаемостей - высокочастотной e¥ и статической e0. В рассматриваемой нами модели могут реализоваться три качественно различных случая, отвечающих трем различным типам состояний валентного электрона: с двумя центрами (ионная пара), с одним центром и поверхностным состоянием (рис. 10). Состояния с двумя центрами имеют два центра сольватации (ион металла и валентный электрон), находящихся внутри кластера. Очевидно, что состояния с двумя центрами должны больше подходить для больших кластеров, т. к. атом щелочного металла распадается внутри макроскопического объема жидкости на ион и сольватированный электрон. Для небольшого числа полярных молекул электрон, вероятно, образует состояние, которое локализуется на ионе металла, в то время как поверхностные состояния электрона образуются, когда взаимодействие между полярными молекулами и ионом металла преобладают по сравнению с взаимодействием, между валентным электроном и ионом.
При континуальном описании поведение потенциала ионизации IP описывается асимптотической зависимостью:
IP(n®¥)=A+Bn-1/3 (3.1.1)
где А и В — константы, которые зависят от типа электронного соcтояния, n - число атомов.
| 
| 
|
| а). | б). | в). |
Рис. 10. Состояния валентного электрона в кластере из полярных молекул содержащего атом металла: а) двух - центровая модель, б) одно - центровая модель, в) модель поверхностного состояния.
Для поверхностных состояний предельное значение А определяется связывани