Известно множество экзотермических реакций пересоединения, при которых образованию связей у продуктов предшествует разрыв связей у реагентов. Тепловой выход здесь объясняют более сильными связями у продуктов по сравнению с реагентами. На первый взгляд, всё логично: реакция идёт в таком направлении, чтобы результирующая конфигурация оказывалась в сильнее связанном состоянии, чем исходная. Но эта исходная конфигурация не может самопроизвольно «скатиться» в более глубокую потенциальную яму. Исходные молекулы имеют собственный запас устойчивости – скажем, в несколько eV – и этот запас устойчивости определяет высоту энергетического барьера, который необходимо преодолеть молекулам реагентов, чтобы могло произойти химическое превращение.
Полагают, что молекулы реагентов попадают на вершину этого энергетического барьера, приобретая т.н. энергию активации [2,3]. Так, для реакций в газовой фазе, энергия активации приобретается, например, в результате столкновений молекул, скорости которых соответствуют высоко-скоростному «хвосту» максвелловского распределения. При таком столкновении, якобы, временно формируется т.н. активированный комплекс [12] – из вмазанных друг в друга молекул реагентов – и этот комплекс скатывается в более связанное состояние, т.е. химические связи переформировываются, после чего продукты реакции разлетаются. Подобная механистическая модель, однако, заводит нас в тупик.
Действительно, присмотримся к диаграмме (Рис.1, [13]), с помощью которой обычно

Рис.1.
иллюстрируют вышеописанный процесс – протекающий «слева направо» (ибо никакой физической величине ось абсцисс не соответствует). Здесь E 2 – это уровень энергии связи реагентов, E 3 – уровень энергии связи продуктов, E – энергия активации, Q – тепловой выход. Согласуется ли подобная диаграмма с феноменом химического равновесия, при котором, в единицу времени, количества элементарных актов прямой и обратной реакций в системе одинаковы, а физические параметры системы – температура, давление – остаются постоянными? Заметим, что, по логике активационного механизма, для возможности обратной реакции – которая является эндотермической и протекает, в терминах диаграммы на Рис.1, «справа налево» - требуется увеличенная энергия активации, равная E + Q. При конкретной температуре системы, число высокоэнергичных частиц, способных обеспечить, при столкновениях, энергию активации E + Q, меньше числа частиц, способных обеспечить энергию активации E. Тогда, казалось бы, равенство скоростей прямой и обратной реакций возможно только в условиях, когда количество реагентов для эндотермической реакции больше, чем для экзотермической. Но практика не подтверждает этот вывод. Приведём пример равновесия между экзотермической реакцией синтеза аммиака и обратной эндотермической реакцией его распада:
N2 + 3H2 «2NH3.
Процентное содержание аммиака в равновесной смеси (N2: H2 = 1: 3) показано на Рис.2 для различных температур и давлений [2]. Как можно видеть, равновесие имеет место отнюдь не только тогда, когда процентное содержание аммиака в смеси доминирует.
Для спасения активационной модели, можно было бы сделать дополнительное допущение: независимо от того, образовался ли активированный комплекс по ходу прямой или обратной реакции, он способен «скатиться» с вершины энергетического барьера в обе стороны. Но нет: химическая кинетика строится на постулате о том, что «скатывание» каждого активированного комплекса продолжает ход той реакции, при которой этот комплекс образовался. Иначе пришлось бы объяснять, почему соотношение вероятностей «скатывания» активированного комплекса «вправо» и «влево» (Рис.1) своеобразно зависит от температуры и давления – а причины такой зависимости едва ли можно усмотреть.
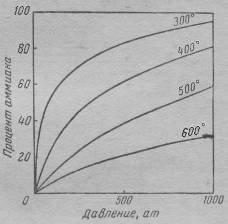
Рис.2.
С учётом вышеизложенного, нам представляется некорректной активационная модель химических реакций – а заодно и традиционная модель феномена катализа, согласно которой, катализаторы уменьшают энергию активации [2,12,13]. Ниже мы укажем на факты, которые свидетельствуют о том, что, например, реакции горения протекают через ряд промежуточных реакций распада и синтеза, т.е. совершенно не так, как говорит активационная модель.