Спецификация билетов
| Номер задания | Контролируемые элементы знаний |
| А1 | Химические реакции в водных растворах. |
| А2 | Качественные реакции неорганической химии. |
| А3 | Обратимые реакции. Условия смещения химического равновесия. |
| А4 | Типы химических реакций. Понятие об окислителе и восстановителе. |
| А5 | Строение атома. Периодическая система химических элементов. Закономерности изменения свойств химических элементов. Химическая связь. |
| В1 | Генетическая связь между классами неорганических веществ. |
| В2 | Задача на определение массовой доли элемента по формуле вещества. Задача на вычисление по уравнениям химических реакций массы, или объёма, или количества вещества по известной массе, или объёму, или количеству вещества одного из реагентов или продуктов реакции. Задача с использованием понятия «массовая доля растворённого вещества». Задача с использованием понятий «Количество вещества. Молярная масса. Молярный объем газов. Относительная плотность газов.» Расчеты объемных отношений газов при химических реакциях. |
| В3* | Расчеты массы (объема, количества вещества) реагентов или продуктов реакции, если одно из веществ дано в виде раствора (смеси веществ) с определенной массовой долей растворенного вещества (вещества в смеси). Нахождение простейшей формулы вещества по массовым долям элементов. Расчеты по термохимическим уравнениям. |
Структура билетов
В каждом билете (их всего 25) содержится 2 блока вопросов по разделам А и В.
Часть А включает 5 заданий базового уровня: 4 задания с выбором ответа (в билете они присутствуют под номерами А1 – А4) и 1 задание – А5 – задание на восстановление соответствия. К каждому из заданийА1 – А4 даны 4 варианта ответа, из которых только один правильный.
Часть В включает 2 задания базового уровня: В1 –задание на превращение веществ, В2 – расчетная задача. Для классов с углубленным уровнем обучения химии обязательным является третье *В3 – расчетная задача.
При ответе учащиеся должны уметь аргументировать свой выбор варианта ответа, давая соответствующие определения, или составляя уравнения реакций по требованию учителя.
Оценивание результатов экзамена
Ответы на задания части А оцениваются 1 баллом (правильный ответ) или 0 баллов (неправильный ответ, отсутствие ответа). Максимальное количество баллов за часть А – 5.
Ответ на задание В1 оценивается 2 баллами (правильный ответ) или 0 баллов (неправильный ответ, отсутствие ответа). Ставится 1 балл, если в ответе допущена одна ошибка.
Расчётная задача В2 оценивается суммой баллов от 5 до 0.
Расчетная задача *В3 оценивается суммой баллов от 7 до 0. В случае, когда в ответе содержится ошибка в вычислениях, которая привела к неверному ответу, оценка за выполнение расчётной задачи снижается только на 1 балл.
Таким образом, максимальное количество баллов за выполнение заданий базового уровня – 14; углублённый уровня – 32 (см.таблицы1 и 2).
Таблица1.
Базовый уровень
| № задания | количество баллов за каждое задание | сумма баллов | |
| часть А | № 1-5 | ||
| частьВ | № 1 | ||
| № 2 | от 5 до 0 | ||
| итого максимальное количество баллов |
Таблица 2.
Углублённый уровень
| № задания | количество баллов за каждое задание | сумма баллов | |
| часть А | № 1-5 | ||
| частьВ | № 1 | ||
| № 2 | от 5 до 0 | ||
| № 3 | от 7 до 0 | ||
| итого максимальное количество баллов |
Критерии оценивания заданий с развёрнутым ответом
В2. Определите объем (н.у.) сернистого газа, который получится при сжигании на воздухе 50 кг серы, содержащей 5% посторонних примесей.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Элементы ответа: 1) составлено уравнение реакции: S + O2= SO2 2) определена массасеры без примесей: m(S) = 0.95*50 = 47.5 (кг) = 47500 (г); 3) определено количество веществаS: n (S) = m/M = 47500 / 32 = 1484.375 (моль) 4) определено количество веществаSO2: n(SO2) = n(S) = 1484.375 (моль) 5) определен объем хлора: V(SO2) = n ∙ Vm= 1484.375 ∙22.4 = 33250 (л) = 33.25 (м3) | |
| Ответ правильный и полный, включает все названные элементы | |
| В ответе допущена ошибка в одном из названных выше элементов | |
| В ответе допущена ошибка в двух из названных выше элементов | |
| В ответе допущена ошибка в трёх из названных выше элементов | |
| В ответе допущена ошибка в четырёх из названных выше элементов | |
| Все элементы ответа записаны неверно | |
| Максимальный балл |
*В3. Вычислите массу осадка, полученного при растворении хлороводорода в растворе объемом 20 см3 (r = 1,05 г/см3)с массовой долей нитрата серебра 3%.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Элементы ответа: 1) составлено уравнение реакции: HCl+ AgNO3 = AgCl + HNO3 2) определены молярные массыAgCl и AgNO3: М(AgCl) = 142,5 г/моль М (AgNO3)= 169г/моль 3) определенамассараствораAgNO3: m р-ра= V ∙ ρ = 20∙ 1,05 = 21 (г) 4) определена массаAgNO3: m(AgNO3) = mр-ра ∙ ω = 21 ∙ 0,03 = 0,63 (г) 5) определено nAgNO3: n (AgNO3) = m/M = 0,63/169= 0,0037 (моль) 6) определено n солиAgCl: n(AgCl) = n(AgNO3) = 0,0037 (моль) 7) определенамассасолиAgCl: m(AgCl) = n ∙ M = 0,0037 ∙ 142,5 = 0,53 (г) | |
| Ответ правильный и полный, включает все названные элементы | |
| В ответе допущена ошибка в первом из названных выше элементов | |
| В ответе допущена ошибка в первом и втором из названных выше элементов | |
| В ответе допущена ошибка в первом, втором и третьем из названных выше элементов | |
| В ответе допущена ошибка в первом, втором, третьем и четвёртом из названных выше элементов | |
| В ответе допущена ошибка в первом, втором, третьем, четвёртом и пятом из названных выше элементов | |
| В ответе допущена ошибка в первом, втором, третьем, четвёртом, пятом и шестом из названных выше элементов | |
| Все элементы записаны неверно | |
| Максимальный балл |
Примерная шкала перевода полученной суммы баллов в традиционную оценку:
Базовый уровень
| оценка | сумма баллов | проценты |
| «5» | 14 – | 100 % 85 % |
| «4» | 11 – | 80 % 65 % |
| «3» | 8– | 60 % 50 % |
| «2» | 6 – | 43 % 0 % |
Углублённый уровень
| оценка | сумма баллов | проценты |
| «5» | 21 – | 100 % 87% |
| «4» | 17 – | 84 % 69 % |
| «3» | 14 – | 65 % 50 % |
| «2» | 10 – | 47 % 0 % |
Билет № 1.
А1. Выберите реакцию ионного обмена, которая не может осуществиться до конца:
| 1) | КОН + Na2S04 → | 3) | AlCl3 + NaOH → | |
| 2) | NaOH + HN03 → | 4) | Zn(OH)2 + КОН → |
А2. Химическое равновесие в системе
С4Н10(г.) ↔ С4Н8(г.) + Н2(г.) - Q
в наибольшей степени можно сместить в сторону продуктов реакции:
1) повышением температуры и повышением давления;
2) повышением температуры и понижением давления;
3) понижением температуры и повышением давления;
4) понижением температуры и понижением давления.
А3. Доказать наличие кислорода в сосуде можно с помощью:
1) известковой воды; 3) раствора хлорида бария;
2) тлеющей лучинки; 4) индикатора.
А4. Концентрированная серная кислота вступает в реакцию с каждым из пары веществ, формулы которых:
| 1) | Au и CuO; | 3) | Si02 и Mg(OH)2; | |
| 2) | Си и CaC03; | 4) | С02 и NaN03; |
A5. Установите соответствие:
| СИМВОЛ ЭЛЕМЕНТА | ВАЛЕНТНЫЕ ЭЛЕКТРОНЫАТОМОВ | |
| O | A) 2s22p2 | |
| S | Б) 3s23p3 | |
| P | В) 2s22p4 | |
| C | Г) 3s23p4 |
B1. В цепочке превращений
Fe  X1
X1  X2
X2  X3
X3  X4
X4
Укажите конечный продукт (Х4)
| 1) | железо | 3) | гидроксид железа (II) | |
| 2) | оксид железа (III) | 4) | гидроксид железа (III) |
В2. Определите объем (н.у.) сернистого газа, который получится при сжигании на воздухе 50 кг серы, содержащей 5% посторонних примесей.
*В3. При восстановлении водородом 60 г смеси меди с оксидом меди (II) образовалось 10,8 г воды. Определите массовую долю (в %) каждого компонента смеси.
Билет № 2.
А1. Выберите реакцию ионного обмена, которая не может осуществиться до конца:
| 1) | Ca(ОН)2 + NaCl → | 3) | FeCl2 + Ba(OH)2 → | |
| 2) | NaOH + HNO3 → | 4) | Cu(OH)2 + КОН → |
А2. Наличие фосфат – ионов в растворе можно определить с помощью раствора
| 1) | нитрата натрия | 3) | нитрата серебра | |
| 2) | азотной кислоты | 4) | нитрата калия |
А3. Для системы
MgO(тв.)+C02 (г.) ↔MgC03(тв.) + 111,7 кДж
выберите условия смещения равновесия в сторону поглощения С02;
| 1) | повышение температуры; | 3) | понижение температуры; | |
| 2) | уменьшение концентрации СО2; | 4) | понижение давления. |
А4. Водородвступает в реакцию с каждым из пары веществ, формулы которых:
| 1) | CаO и О2; | 3) | Mg(OH)2и Мg; | |
| 2) | СиО и N2; | 4) | FeO и H2O. |
A5. Установите соответствие:
| СИМВОЛ ЭЛЕМЕНТА | ВАЛЕНТНЫЕ ЭЛЕКТРОНЫАТОМОВ | |
| Mg | B) 4s2 | |
| Ca | Б) 3s23p4 | |
| S | В) 3s2 | |
| Si | Г) 3s23p2 |
B1. Осуществите следующие превращения
O2  X1
X1  X2
X2  Al(OH)3
Al(OH)3  Al2O3
Al2O3
Назовите вещества Х1 и Х2.
В2. Технический магний массой4,6 гобработали избытком раствора соляной кислоты. При этом выделилось 6,35 л газа (н.у.). Вычислите массовую долю (в %) магния в образце.
*В3. Вычислите массу осадка, полученного при растворении хлороводорода в растворе объемом 20 см3 (r = 1,05 г/см3)с массовой долей нитрата серебра 3%.
Билет № 3.
А1. Сокращенному ионному уравнению
Fe2+ + 20Н-=Fe(OH)2¯
соответствуем реакция между:
1) хлоридом железа (II) и водой;
2) железом металлическим и водой;
3) хлоридом железа(III) и гидроксидом калия;
4) хлоридом железа (II) и гидроксидом натрия.
А2. Наличие сульфат – ионов в растворе можно определить с помощью раствора
| 1) | нитрата калия | 3) | нитрата бария | |
| 2) | нитрата магния | 4) | нитрата цинка |
А3. В системе
2СО(г.) + 02(г.) ↔ 2С02(г.) + Q
смещению химического равновесия в сторону исходных веществ будет способствовать:
1) увеличение давления;
2) увеличение концентрации оксида углерода (IV);
3) уменьшение температуры;
4) увеличение концентрации кислорода.
А4. С растворами фосфорной кислоты и хлорида натрия взаимодействует:
| 1) | нитрат кальция; | 3) | гидроксид калия; | |
| 2) | нитрат бария. | 4) | нитрат серебра; |
A5. Установите соответствие:
| СИМВОЛ ЭЛЕМЕНТА | ВАЛЕНТНЫЕ ЭЛЕКТРОНЫАТОМОВ | |
| магний | А) 2s22p2 | |
| фосфор | Б) 3s23p1 | |
| углерод | В) 3s2 | |
| алюминий | Г) 3s23p3 |
B1. В схеме превращений
FeCl3  Fe(OH)3
Fe(OH)3  FeCl3
FeCl3  AgCl
AgCl
веществами А, В, С являются соответственно
| 1) | КOH, НС1, AgN03; | 3) | NaOH, NaCl, AgNO3 | |
| 2) | Н20, НС1, AgN03; | 4) | Н20, NaOH, AgN03; |
В2. Вычислите объем (н.у.) хлора, образовавшегося при взаимодействии оксида марганца (IV) массой 8,7 г с соляной кислотой взятой в избытке.
*В3. Водный раствор, содержащий гидроксид кальция массой 3,7 г, поглотил оксид углерода (IV) объёмом 1,68 л (н. у.). Вычислите массу образовавшегося осадка.
Билет № 4.
А1. Какая из следующих реакций является реакцией обмена?
1) реакция водорода с серой;
2) реакция оксида кальция с водой;
3) реакция оксида серы (VI) с оксидом натрия;
4) реакция соляной кислоты с оксидом магния.
А2. Различить галогеноводородные кислоты можно с помощью одного реактива. Этот реактив –
| 1) | хлорная вода; | 3) | крахмальный клейстер; | |
| 2) | нитрат серебра; | 4) | медь. |
А3. Для смещения химического равновесия реакции
2NО(г.) + O2(г.) ↔2NO2(г.) + Q
в сторону образования оксида азота (IV) необходимо:
5) повысить температуру;
6) понизить давление;
7) использовать катализатор;
8) увеличить концентрацию кислорода.
А4. С раствором фосфорной кислоты и хлорида кальция взаимодействует:
| 1) | гидроксид калия; | 3) | нитрат серебра; | |
| 2) | оксид алюминия; | 4) | вода. |
A5. Установите соответствие:
| СИМВОЛ ЭЛЕМЕНТА | ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ | |
| кальций | А)ls22s22p63s23p4 | |
| сера | Б)ls22s22p63s23p64s1 | |
| азот | В) ls22s22p63s23p64s2 | |
| калий | Г)ls22s22p3 |
B1. Осуществите превращения
S  X1
X1  X2
X2  X3
X3  X4
X4
назовите вещества Х1, Х2, Х3, Х4.
В2. К 30г раствора, содержащего 5% сульфата меди (II) добавили гидроксид калия.Вычислите массу образовавшегося осадка.
*В3. К 500 см3 20%-ного раствора (r = 1,23 г/см3) прибавили 200г воды. Вычислите массовую долю (в %) растворенного вещества в полученном растворе.
Билет № 5.
А1. С выпадением осадка протекает реакция ионного обмена между растворами:
1) гидроксида калия и хлорида бария;
2) сульфата хрома (III) и гидроксида натрия;
3) нитрата магния и бромида натрия;
4) хлорида аммония и нитрата кальция.
А2. При добавлении раствора хлорида калия к раствору нитрата серебра
1) выпадает осадок;
2) выпадает осадок и выделяется газ;
3) выделяется газ;
4) видимых изменений не происходит.
А3. Для смещения химического равновесия реакции
СО2(г.) + С(т)↔ 2СО(г.)– 173 кДж
в сторону образования оксида углерода(II) необходимо:
1) повысить температуру;
2) увеличить давление;
3) использовать катализатор;
4) увеличить концентрацию угарного газа.
А4. Для получения оксида серы (IV) невозможно использовать химическую реакцию
| 1) | S + O2 → | 3) | BaCO3 
| |
| 2) | H2S + O2→ | 4) | Na2SO3 + HCl→ |
A5. Установите соответствие:
| ФОРМУЛА СОЕДИНЕНИЯ | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА В СОЕДИНЕНИИ | |
| NH3 | А)+ 4 | |
| NO2 | Б)+ 1 | |
| HNO3 | В) - 3 | |
| N2O | Г)+ 5 |
B1. Осуществите превращения
Na  X1
X1 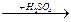 X2
X2  X3
X3
назовите вещества Х1, Х2, Х3,укажите тип каждой реакции.
В2. В 500 см3 воды растворили 11,2 л хлороводорода (н.у.). Вычислите массовую долю (в %) хлороводорода в растворе.
*В3. При сжигании 1,12 л (н.у.) ацетилена выделилось 67,5 кДж теплоты. Вычислите тепловой эффект реакции горения ацетилена и составьте термохимическое уравнение этой реакции.
Билет № 6.
А1. Одновременно в растворе не могут находиться ионы:
| 1) | Mg2+, Na+, Cl-, NO3-; | 3) | NH4+, Fe3+, Br-, I-; | |
| 2) | Ag+, Cu2+, I-, NO3-; | 4) | Cu2+, K+, Br-, SO42-. |
А2. Какое из следующих свойств характеризует щелочи?
1) взаимодействуют с кислотами и кислотными оксидами;
2) взаимодействуют с амфотерными и основными оксидами;
3) взаимодействуют с солями и основаниями;
4) взаимодействуют с индикаторами и основными оксидами.
А3. Для смещения химического равновесия реакции
2 SО2(г.) + O2(г)↔ 2SО3(г.)+Q
в сторону образования оксида серы (VI) необходимо:
1) понизить температуру;
2) понизить давление;
3) использовать катализатор;
4) повысить температуру.
А4. Какой химический элемент не образует аллотропных модификаций?
| 1) | углерод; | 3) | азот; | |
| 2) | кислород; | 4) | фосфор. |
A5. Установите соответствие:
| СИМВОЛ ЭЛЕМЕНТА | ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ | |
| Na | А)ls22s22p63s23p64s14p0 | |
| K | Б)ls22s22p63s13p0 | |
| C | В) ls22s22p63s23p2 | |
| Si | Г)ls22s22p2 |
B1. Осуществите превращения
Ca  X1
X1  X2
X2 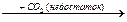 X3
X3  X4
X4
назовите вещества Х1, Х2, Х3,X4.
В2. Вычислите массу оксида кальция, полученного при обжиге 350 г известняка, содержание в котором карбоната кальция составляет 85%.
*В3. По термохимическому уравнению реакции горения метана
CH4(г.) + 2 O2(г.)= CO2(г.) + 2 H2O(г.)+ 890 кДж
вычислите количество теплоты, выделяющейся при сжигании 112л (н.у.) метана.
Билет № 7.
А1. Краткому ионному уравнению Н+ + ОН- → Н2О соответствует взаимодействие следующих пар веществ:
| 1) | HCl + Ba(OH)2; | 3) | H2CO3 + NaOH; | |
| 2) | Cu(OH)2 + HNO3; | 4) | HCl + HNO3. |
А2. Для определения сульфат – ионов в растворе к нему необходимо добавить раствор
| 1) | Ba(OH)2; | 3) | NaOH; | |
| 2) | Cu(NO3)2; | 4) | NН3. |
А3. В какой системепри повышении давленияхимическое равновесие сместится вправо?
| 1) | 2 HI(г.)↔ H2(г.) + I2(г.); | 3) | C3H6(г.) + H2(г.)↔ C3H8(г.); | |
| 2) | C(тв.) + S2(г.)↔ CS2(г.); | 4) | H2(г.) + F2(г.)↔ 2 HF(г.). |
А4. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
| 1) | Cl2, NH3, HCl; | 3) | H2S, H2O, S8; | |
| 2) | HBr, Br2, NO; | 4) | HI, H2O, PH3. |
A5. Установите соответствие:
| СИМВОЛ ЭЛЕМЕНТА | ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ | |
| F | А)ls22s22p63s1 | |
| Cl | Б)ls22s22p6 | |
| Na | В) ls22s22p63s23p5 | |
| Ne | Г)ls22s22p5 |
B1. Осуществите превращения
Э  ЭCl2
ЭCl2  ЭCl3
ЭCl3  Э(NO3)3
Э(NO3)3  Э(OH)3
Э(OH)3
Укажите элемент (Э) в цепочке превращений
| 1) | алюминий; | 3) | цинк; | |
| 2) | железо; | 4) | медь. |
В2. Вычислите массу оксида кальция, полученного при обжиге 350 г известняка, содержание в котором карбоната кальция составляет 85%.
*В3. По термохимическому уравнению реакции горения метана
CH4(г.) + 2 O2(г.)= CO2(г.) + 2 H2O(г.)+ 890 кДж
вычислите количество теплоты, выделяющейся при сжигании 112л (н.у.) метана.
Билет № 8
А1. Краткому ионному уравнению 2Н+ + SiO32- → Н2SiO3 соответствует взаимодействие следующих пар веществ:
| 1) | SiO2 + NaOH; | 3) | SiO2 + HCl; | |
| 2) | K2SiO3 + HNO3; | 4) | CaSiO3+ Zn(OH)2. |
А2. Индикатором лакмус можно рассмотреть оба вещества пары
| 1) | Ba(OH)2(р-р) HCl; | 3) | NaOH и Н2SiO3; | |
| 2) | Cu(ОН)2 и HNO3 | 4) | Zn(OH)2и КОН. |
А3. На состояние химического равновесия в системе
Н2(г.) + I2(г.)↔ 2HI(г.)–Q
не влияет:
1) увеличение температуры;
2) увеличение давления;
3) увеличение концентрации водорода;
4) уменьшение температуры.
А4. Раствор серной кислоты реагирует:
| 1) | с серебром; | 3) | с оксидом кремния (IV); | |
| 2) | с водородом; | 4) | с оксидом меди (II). |
A5. Установите соответствие:
| ХИМИЧЕСКИЙ ЭЛЕМЕНТ | ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ | |
| литий | А)ls22s22p1 | |
| бериллий | Б)ls22s1 | |
| бор | В) ls22s22p0 | |
| углерод | Г)ls22s22p2 |
B1. Осуществите превращения
AlCl3  X1
X1  X2
X2  X3
X3  X4
X4
назовите вещества Х1, Х2, Х3, Х4.
В2. Установите химическую формулу вещества, если известны массовые доли элементов, входящих в его состав: Fe— 28%, S— 24%, О — 48%.
*В3. При взаимодействии 224г порошка некоторого металла с хлором образовалось 650г хлорида, в котором данный металл трехвалентен. Установите металл.
Билет № 9.
А1. Краткому ионному уравнению 2Н+ + SiO32- → Н2SiO3 соответствует взаимодействие следующих пар веществ:
| 1) | HNO3+ Ba SiO3; | 3) | H2CO3 + SiO2; | |
| 2) | Cu(OH)2 + SiO2; | 4) | H2 SO4 + Na2SiO3. |
А2. Для определения карбонат – ионов в растворе к нему необходимо добавить раствор
| 1) | Ba(OH)2; | 3) | NaOH; | |
| 2) | Cu(NO3)2; | 4) | HNO3. |
А3. Раствор силиката натрия реагирует с
| 1) | оксидом железа (II); | 3) | оксидом углерода (II); | |
| 2) | нитратом калия; | 4) | оксидом углерода (IV). |
А4. В каком ряду записаны формулы веществ только с ионной связью?
| 1) | Cl2, NH3, NaCl; | 3) | MgS, Na2O, SO3; | |
| 2) | KBr, CO2, NO; | 4) | KI, Li2O, FeCl3. |
A5. Установите соответствие:
| СИМВОЛ ЭЛЕМЕНТА | ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ | |
| Li | А)ls22s22p4 | |
| Na | Б)ls22s22p3 | |
| N | В) ls22s22p63s13p0 | |
| O | Г)ls22s12p0 |
B1. Осуществите превращения
CaO  X1
X1  X2
X2  X3
X3
Укажите конечный продукт Х3в цепочке превращений
| 1) | Cа(OH)2; | 3) | СаСО3; | |
| 2) | CaO; | 4) | Са(НСО3)2 |
В2. Вычислите объем кислорода (н.у.), который можно получить из 450 г 3% - ного раствора пероксида водорода..
*В3. К 19,6 г 20%-ного раствора серной кислоты прилили 40мл 0,5 М раствора гидроксида натрия. Установите среду полученного раствора.
Билет № 10.
А1. Краткому ионному уравнению 2Н+ + СO32- → Н2O + СО2 соответствует взаимодействие следующих пар веществ:
1) азотная кислота и оксид углерода (IV);
2) углекислый газ и гидроксид калия;
3) азотная кислота и карбонат кальция;
4) карбонат натрия и соляная кислота.
А2. Распознать углекислый газ можно, пропустив его через раствор
| 1) | хлорида натрия; | 3) | нитрата кальция; | |
| 2) | гидроксида кальция; | 4) | гидроксида натрия. |
А3. Какая схема соответствует разложению нитрата натрия при нагревании?
| 1) | Na20 + N205; | 3) | NaN02 + 02; | |
| 2) | Na + 02 + NO; | 4) | Na3N + 02 |
А4. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
| 1) | Cl2, NH3, КCl; | 3) | Р2О5, К2O, SO3; | |
| 2) | НBr, CO2, NO; | 4) | KI, Li2O, Fe. |
A5. Установите соответствие:
| ФОРМУЛА СОЕДИНЕНИЯ | СТЕПЕНЬ ОКИСЛЕНИЯ ХЛОРА В СОЕДИНЕНИИ | |
| Cl2O7 | А)+ 1 | |
| HCl | Б)+ 7 | |
| HCLO3 | В) -1 | |
| Cl2O | Г)+ 5 |
B1. Осуществите превращения
CuCl2  X1
X1  X2
X2  X3
X3
Укажите конечный продукт Х3 в цепочке превращений
| 1) | гидроксид меди (II); | 3) | оксид меди (II); | |
| 2) | хлорид меди (II); | 4) | медь (II). |
В2. Вычислите массу сульфата магния, который образуется при взаимодействии магния с 5%-ным раствором серной кислоты, масса которого 9,8г.
*В3. Какой объемгаза (н.у.) выделится при действии на 9 г сульфида желе за (II), содержащего 2,2% не реагирующих с кислотой примесей, 98 г 2%-ногораствора серной кислоты?
Билет № 11.
А1. Краткому ионному уравнению Ag++ Сl- =AgCl↓соответствует взаимодействие следующих пар веществ:
| 1) | Ag20 и НCl; | 3) | AgBr и НCl; | |
| 2) | AgN03и НCl; | 4) | Ag20 и КCl. |
А2. Газ, который можно собирать методом вытеснения воздуха из перевернутой вверх дном пробирки называется
| 1) | водород; | 3) | углекислый газ; | |
| 2) | кислород; | 4) | сероводород. |
А3. В системе
4НС1 (г.) + О2(г.) ↔ 2Н2О(г.) + 2С12(г.).
смещению химического равновесия в сторону продуктов реакции будет способствовать:
1) использование катализатора;
2) повышение давления;
3) понижение давления;
4) изменение давления не окажет влияния на смещение химического равновесия.
А4. Способность атомов принимать электроны увеличивается в ряду:
| 1) | Sе – Те – O – S | 3) | Те – Sе – S - O | |
| 2) | O – S – Sе – Те | 4) | Sе – Те – S – O |
A5. Установите соответствие:
| СХЕМА ПРЕВРАЩЕНИЯ | УРАВНЕНИЕ ХИМИЧЕСКОЙ РЕАКЦИИ | |
| Р0 → Р+3 | А)4Р + 5O2 = 2Р2О5 | |
| Р-3 → Р+5 | Б)4Р + 3O2 = 2Р2О3 | |
| Р0 → Р+5 | В) 3Mg + 2Р = Мg3 P2 | |
| Р0 → Р-3 | Г)2РН3 + 4O2 = Р2О5 + 3Н2О |
B1. Осуществите превращения
Zn  X1
X1  X2
X2  X3
X3
Укажите конечный продукт Х3 в цепочке превращений
| 1) | гидроксидцинка; | 3) | оксид цинка; | |
| 2) | цинкат калия; | 4) | цинк. |
В2. При обработке 300 г древесной золы избытком соляной кислоты, получили 44,8л(н.у.) углекислого газа. Какова массовая доля (в%) карбоната калия в исходном образце золы?
*В3. Технический цинк массой 33г обработали разбавленным раствором серной кислоты.Выделившийся водород при нормальных условиях занимает объём 11,2л. Рассчитайте массовую долю цинка в техническом образце металла.
Билет № 12.
А1. Краткому ионному уравнению Ва2++ SO42- =BaSO4↓ соответствует взаимодействие следующих пар веществ:
1) гидроксид бария и сульфат цинка;
2) гидроксид бария и сернаякислотв;
3) оксид бария и серная кислота;
4) барий и серная кислота.
А2. Аллотропными формами одного и того же элемента являются
| 1) | кислород и озон; | 3) | жидкая вода и лед; | |
| 2) | кварц и кремень; | 4) | чугун и сталь |
А3. В ряду элементов O → S → Se → Te уменьшаются
1) радиусы атомов 2) число электронов на внешнем уровне
3) металлические свойства 4) неметаллические свойства
А4. Углекислый газ в лаборатории получают:
| 1) | окислением угарного газа | 3) | действием кислоты на мрамор | |
| 2) | сжиганием угля | 4) | сжиганием метана |
A5. Установите соответствиемежду формулой реагента и формулами веществ, которые вступают с ним в реакцию
| РЕАГЕНТ | ВЕЩЕСТВА | |
| 1) HBr | А)HNO3, FeCl3 | |
| 2) LiOH | Б)MgO, H2O | |
| 3) SO2 | В) NaOH, H3PO4 | |
| 4) Zn(NO3)2 | Г)Ca(OH)2, Fe |
B1. Осуществите превращения
Р  X1
X1  X2
X2  X3
X3
Укажите конечный продукт Х3 в цепочке превращений
| 1) | дигидрофосфат кальция; | 3) | фосфат кальция; | |
| 2) | гидрофосфат кальция; | 4) | фосфид кальция. |
В2. К 150г раствора, содержащего 0,1 ма