Дано:


| Решение:
1. Рассчитываем молярную концентрацию серной кислоты:
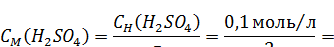


|
Найти:

|
2. Определяем количество вещества серной кислоты:
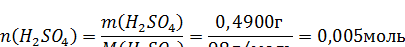
3. Рассчитываем объем раствора:

Ответ: 100мл
9. Вычислите массу 30%-ного раствора перекиси водорода, необходимую для приготовления 300 г 3%-ного раствора.
Дано:



| Решение:
1. Рассчитываем массу пероксида водорода:

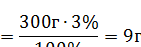 2. Так как раствор получен путем разбавления, масса растворенного вещества не меняется.
2. Так как раствор получен путем разбавления, масса растворенного вещества не меняется.
|
Найти:

|
3. Рассчитываем массу исходного раствора:

Ответ: для приготовления 300г 3%-ного раствора необходимо 30г 30%-ного раствора перекиси водорода
10. Вычислите массу Na2SO4 · 10H2O и объем воды, необходимые для приготовления 50 г 14,2%-ного раствора.
Дано:


| Решение:
1. Рассчитываем массу растворенного сульфата натрия:

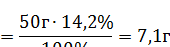
|
Найти:
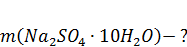

|
2. Определяем количество вещества сульфата натрия:

3. Так как в молекулу кристаллогидрата входит одна молекула сульфата натрия, то:
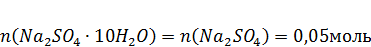
4. Рассчитываем массу кристаллогидрата:


5. Определяем массу воды:

Ответ: для приготовления 50 г 14,2%-ного растворанеобходимо 16,1г Na2SO4 · 10H2O растворить в 33,9г воды.
11. Для обработки рук хирурга, ран, операционного поля используется йодная настойка с массовой долей 5%. В каком массовом соотношении нужно смешать растворы с массовыми долями йода 2,5% и 30%, чтобы получить 330г йодной настойки с массовой долей 5%?
Дано:


 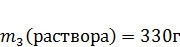
| Решение:
 1.Используя правило смешения, составляем пропорцию: 1.Используя правило смешения, составляем пропорцию:

|
Найти:

|
Ответ: для приготовления 330г 5%-ной йодной настойки необходимо смешать растворы йода с массовыми долями 2,5% и 30% в соотношении 10:1
12. При некоторых аллергических заболеваниях взрослым назначают раствор с массовой долей хлорида кальция CaCl2 – 10%, детям - с массовой долей CaCl2 - 5%. Рассчитайте массу 10%-ного и 2%-ного растворов CaCl2, которые необходимы для приготовления 400г 5%-ного раствора CaCl2.
Дано:
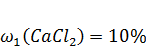

 
| Решение:
1. Рассчитываем массу растворенного хлорида кальция в конечном растворе:
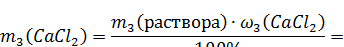
 2. Пусть масса первого раствора составляет:
2. Пусть масса первого раствора составляет:

|
Найти:

|
тогда масса второго раствора:

3. Определяем массу растворенного хлорида кальция в первом и втором растворах:
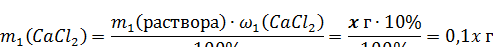

4. Исходя из того, что:

Получаем:
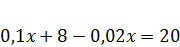



Ответ: для приготовления 400г 5%-ного раствора CaCl2 необходимо смешать 150г 10%-ного и 250г 2%-ного растворов.
13. Дать название и разобрать комплексные соединения: K4[Fe(CN)6], [Ag(NH3)2]Cl, К3[AlF6]
Решение:
| Формула | K4[Fe(CN)6] | [Ag(NH3)2]Cl | К3[AlF6] |
| Название | Гексацианоферрат (II) калия | Хлорид диамино серебра | Гексафторалюминат калия |
| Комплексо-образова-тель | Fe | Ag | Al |
| Координационное число | |||
| Лиганды | CN- | NH3 | F- |
| Ионы внутренней сферы | [Fe(CN)6]4- | [Ag(NH3)2]+ | [AlF6]3- |
| Ионы внешней сферы | K+ | Cl- | K+ |
| Уравнение диссоциации комплексной соли | K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4- | [Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl- | К3[AlF6]→ 3К+ + [AlF6]3- |
| Уравнение диссоциации комплексного иона | [Fe(CN)6]4- 
 Fe2+ + 6CN- Fe2+ + 6CN-
| [Ag(NH3)2]+ 
 Ag+ + 2NH3 Ag+ + 2NH3
| [AlF6]3-  Al3++ 6F- Al3++ 6F-
|
| Выражение для константы нестойкости | 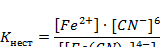
| 
| 
|
14. Дать название и разобрать комплексные соединения: K3[Fe(CN)6], [Cu(NH3)4]Cl2, K3[Co(NO2)6]
Решение:
| Формула | K3[Fe(CN)6] | [Cu(NH3)4]Cl2 | K3[Co(NO2)6] |
| Название | Гексацианоферрат (III) калия | Хлорид тетраамино меди (II) | Гексанитрокобальтат (III) калия |
| Комплексо-образова-тель | Fe | Cu | Co |
| Координационное число | |||
| Лиганды | CN- | NH3 | NO2- |
| Ионы внутренней сферы | [Fe(CN)6]3- | [Cu(NH3)4]2+ | [Co(NO2)6]3- |
| Ионы внешней сферы | K+ | Cl- | K+ |
| Уравнение диссоциации комплексной соли | K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3- | [Cu(NH3)4]Cl2 → [Cu(NH3)4]2+ + 2Cl- | К3[Co(NO2)6]→ 3К+ + [Co(NO2)6]3- |
| Уравнение диссоциации комплексного иона | [Fe(CN)6]3- 
 Fe3+ + 6CN- Fe3+ + 6CN-
| [Cu(NH3)4]2+ 
 Cu2+ + 4NH3 Cu2+ + 4NH3
| [Co(NO2)6]3-  Co3++ 6NO2- Co3++ 6NO2-
|
| Выражение для константы нестойкости | 
| 
| 
|
15. Дать название и разобрать комплексные соединения: Na3[Co(NO2)6], [Zn(NH3)4]SO4, K[Ag(CN)2]
Решение:
| Формула | Na3[Co(NO2)6] | [Zn(NH3)4]SO4 | K[Ag(CN)2] |
| Название | Гексанитрокобальтат (III) натрия | Сульфат тетраамино цинка | Дицианоаргентат калия |
| Комплексообразователь | Co | Zn | Ag |
| Координационное число | |||
| Лиганды | NO2- | NH3 | F- |
| Ионы внутренней сферы | [Co(NO2)6]3- | [Zn(NH3)4]2+ | [Ag(CN)2]- |
| Ионы внешней сферы | Na+ | SO42- | K+ |
| Уравнение диссоциации комплексной соли | Na3[Co(NO2)6] → 3Na+ + [Co(NO2)6]3- | [Zn(NH3)4]SO4→ [Zn(NH3)4]2+ + SO42- | K[Ag(CN)2] → K+ + [Ag(CN)2]- |
| Уравнение диссоциации комплексного иона | [Co(NO2)6]3-  Co3++ 6NO2- Co3++ 6NO2-
| [Zn(NH3)4]2+ 
 Zn2+ + 4NH3 Zn2+ + 4NH3
| [Ag(CN)2]-  Ag++ 2CN- Ag++ 2CN-
|
| Выражение для константы нестойкости | 
| 
| 
|
16. Дать название и разобрать комплексные соединения: [Cr(H2O)6]Cl3, K2[Cu(OH)4], K3[Co(NO2)6]
Решение:
| Формула | [Cr(H2O)6]Cl3 | K2[Cu(OH)4] | K3[Co(NO2)6] |
| Название | Хлорид гексааквахрома (III) | Тетрагидроксокупрат (II) калия | Гексанитрокобальтат (III) калия |
| Комплексо-образова-тель | Cr | Cu | Co |
| Координационное число | |||
| Лиганды | H2O | OH- | NO2- |
| Ионы внутренней сферы | [Cr(H2O)6]3+ | [Cu(OH)4]2- | [Co(NO2)6]3- |
| Ионы внешней сферы | Cl- | K+ | K+ |
| Уравнение диссоциации комплексной соли | [Cr(H2O)6]Cl3→ [Cr(H2O)6]3+ + 3Cl- | K2[Cu(OH)4] → 2K+ + [Cu(OH)4]2- | К3[Co(NO2)6]→ 3К+ + [Co(NO2)6]3- |
| Уравнение диссоциации комплексного иона | [Cr(H2O)6]3+  Cr3+ + 6H2O Cr3+ + 6H2O
| [Cu(OH)4]2-  Cu2+ + 4OH- Cu2+ + 4OH-
| [Co(NO2)6]3-  Co3++ 6NO2- Co3++ 6NO2-
|
| Выражение для константы нестойкости | 
| 
| 
|
17. Дать название и разобрать комплексные соединения: [Pt(NH3)3Cl]Cl, K2[HgI4], [Cu(NH3)4]SO4
Решение:
| Формула | [Pt(NH3)3Cl]Cl | K2[HgI4] | [Cu(NH3)4]SO4 |
| Название | Хлорид триаминохлор платины (II) | Тетрайодомеркурат (II) калия | Сульфат тетраамино меди (II) |
| Комплексообразователь | Pt | Hg | Cu |
| Координационное число | |||
| Лиганды | NH3, Cl- | I- | NH3 |
| Ионы внутренней сферы | [Pt(NH3)3Cl]+ | [HgI4]2- | [Cu(NH3)4]2+ |
| Ионы внешней сферы | Cl- | K+ | SO42- |
| Уравнение диссоциации комплексной соли | [Pt(NH3)3Cl]Cl → [Pt(NH3)3Cl]+ + Cl- | K2[HgI4] → 2K+ + [HgI4]2- | [Cu(NH3)4]SO4→ [Cu(NH3)4]2+ + SO42- |
| Уравнение диссоциации комплексного иона | [Pt(NH3)3Cl]+  Pt2+ + 3NH3 + Cl- Pt2+ + 3NH3 + Cl-
| [HgI4]2-  Hg2+ + 4I- Hg2+ + 4I-
| [Cu(NH3)4]2+ 
 Zn2+ + 4NH3 Zn2+ + 4NH3
|
| Выражение для константы нестойкости | 
| 
| 
|