- Заполнить таблицу «Типы реакций биологического окисления».
| Тип реакции | Схема процесса | Ферменты | Биологическая роль |
| 1 | |||
| 2 | |||
| 3 | |||
| 4 |
2. Выписать в общем виде уравнения реакций катализируемых пиридин- и флавинзависимыми дегидрогеназами.
SH2 + НАД+→
SH2 + ФАД→
Привести активные структуры в молекулах НАД+ и ФАД, которые являются акцепторами протонов и электронов в дегидрогеназных реакциях.
Краткие методические рекомендации к проведению заняття.
На занятии проводится тестовый контроль исходного уровня знаний студентов и его коррекция. Проверяется выполнение домашнего задания. Затем студенты приступают к выполнению лабораторной работы, используя при этом инструкцию.
После выполнения лабораторной работы необходимо оформить протокол,сделать выводы к работе, которые проверяет и контролирует преподаватель.Проводится итоговый тестовый контроль по теме, подводятся итоги работы.
Инструкция к практическому занятию «Исследование типов биологического окисления».
РАБОТА №1: Открытие альдегиддегидрогеназы в молоке.
Принцип работы: Фермент вырабатывается микроорганизмами, попадающими в молоко извне. По химической природе он относится к флавопротеинам, способным окислять альдегиды, в частности формальдегид. При добавлении к некипяченому молоку формальдегида метиленовой сини альдегиддегидрогеназа окисляет формальдегид в муравьиную кислоту, а освобождающийся при этом водород переносится на метиленовую синь, востанавливая ее в бесцветное соединение.
Материальное обеспечение: кипяченое молоко, не кипяченое молоко, 0,04% раствор формальдегида, 0,01% раствор метиленовой сини, пробирки, пипетки.
Ход работы: В одну пробирку вносять 15 капель кипяченого молока, а в другую – 15 капель не кипяченого. В каждую пробирку вносят по капле 0,4% раствора формальдегида и по капле 0,01% раствора метиленовой сини. Пробирки встряхивают и закрывают пробками, чтобы создать относительные анаэробныеусловия.
Пробирки помещают в термостат при 37º С и отмечают через пять минут постепенное обесцвечивание метиленовой сини.
ВЫВОДЫ:
РАБОТА №2 Обнаружение каталазы крови
Принцип работы: Фермент каталаза относится к классу оксидоредуктаз. Этот фермент содержится во всех тканях и жидкостях организма, но особенно много его в строме эритроцитов и печени. В процессе окисления некоторых веществ образуется перекись водорода, ядовитая для организма, которая может в нем накапливаться.
Биологическая роль каталазы заключается в разложении вредной для организма перекиси водорода на молекулярный кислород и воду:
 2Н2О2 2Н2О + О2
2Н2О2 2Н2О + О2
каталаза
Фермент каталаза содержит гем.
Материальное обеспечение: 3% раствор перекиси водорода, кровь.
Ход работы: В пробирку вносять 10-15 капель 3% Н2О2 и 1 каплю крови. Отмечают выделение пузырьков кислорода.
Подпись преподавателя:
Приложение 1.
Г р а ф логической структуры к теме: «Исследование типов биологического окисления».
 | |||||
 | |||||
 |



|
 |
 |
Механизм антиоксидантного действия
жирорастворимых витаминов
 | |||||
| |||||
 |
Приложение 2
ВЗАИМОСВЯЗЬ ОБМЕНА ВЕЩЕСТВ
И ЭНЕРГИИ. ЦИКЛ АТР-АDР.
Пищевые вещества
 1
1
Метаболиты 4 Распад
структурно-
Катаболизм Анаболизм функциональных
2 компонентов
5 7
Энергия
6
Рис.1. Общая схема обмена веществ и энергии.
1 - пищеварение; 2,4- катаболизм; 3- анаболизм; 5- экзергонические реакции; 6,7- эндергонические реакции.
1. Обмен веществ включает три этапа:
1)поступление веществ в организм;
2) метаболизм, или промежуточный обмен;
3) выделение конечных продуктов обмена
1.1. Реакции катаболизма сопровождаются выделением энергии (экзергонические реакции), а её использование связано с реакциями анаболизма и физиологической активностью организма (эндергонические реакции).
1.2. Центральную роль энергетическом обмене выполняет АТР:
а) в макроэргических связях АТР аккумулируется энергия, выделяемая в процессе катаболизма;
б) энергия АТРиспользуется в реакциях анаболизма и обеспечивает различные виды работы в организме.
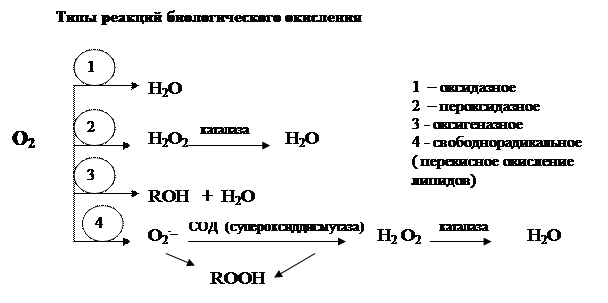
2. Процессы катаболизма в клетках животных сопровождаются потреблением кислорода, который необходим для реакций окисления. Ферменты, катализирующие окислительно-восстановительные реакции, называются оксидоредуктазами. Их подразделяют на 4 группы:
2.1. Дегидрогеназы катализируют перенос водорода от субстрата (S) на кофермент акцептор (А).
SН2 + А → S + АН2 есть: две основные группы дегидрогеназ, которые различаются по используемым коферментам.
2.1.1. Пиридинзавасимые дегидрогеназы (кофермент НАД+ или НАДФ+). Никотинамид синтезируется в организме из триптофана или поступает с пищей (витамин РР).
2.1.2. Флавиновые дегидрогеназы (кофермент ФАД или ФМН). ФМН и ФАД образуются в организме из рибофлавина (витамин В2).
2.2. Оксидазы – катализируют перенос электронов от S на молекулярный кислород
SН2 +1/2О2 → S + Н2О SН2 +О2 → S + Н2О2.
2.3. Оксигеназы катализирует включение кислорода в молекулу органического субстрата. Их подразделяют на две группы, в зависимости от:
-диоксигеназы, количество атомов кислорода, которое взаимодействует с S:
S + О2→SО2
- монооксигеназы: S -Н + О2 + АН2 → SОН + А + Н2 О
- гидропероксидазы (пероксидазы и каталазы) катализируют разрушение перекиси водорода. 2Н2О2 → 2Н2О +О2.
2.4 Свободнорадикальное окисление
Окисление субстратов свободными радикал-анионами: супероксидом О2· -, Н2О2, и наиболее активным радикалом – гидроксил анионом ОН·
Пути образования свободных радикалов;
- Реакции восстановления кислорода до Н2 О в дыхательной цепи - основной: источник свободных радикалов

- Некоторые метаболические процессы (микросомальное окисление, распад пуриеовых нуклеотидов, фагоцитоз идр.)
Свободные радикалы вызывают образование органических гидропероксидов (ROOH) ДНК, белков и липидов.
Приложение 3