МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПО ЗЕМЛЕУСТРОЙСТВУ»
Факультет Городской кадастр
Кафедра физики
Специальность Геодезия и дистанционное зондирование
Реферат
«Ядерная модель атома
Постулаты Бора
Правила квантования
Спектральные серии атомов водорода»
Студент________________
Власов М.С.
Группа 21-ДЗ
Преподаватель __________
Прокофьев Л.Н.
Москва 2016
Ядерная модель атома
Резерфорд на основании результатов эксперимента по рассеянию
α-частиц на атомах металлической фольги обосновал планетарную модель строения атома.
Согласно этой модели, атом состоит из тяжёлого положительно заряженного ядра очень малых размеров (~ 10-15 м), вокруг которого по некоторым орбитам движутся электроны. Радиусы этих орбит имеют размеры ~ 10-10 м.
Наличие у электрона заряда делает планетарную модель противоречивой с точки зрения классической физики, т.к. вращающийся вокруг ядра электрон, как и любая ускоренно движущаяся заряженная частица должен излучать электромагнитные волны. Спектр такого излучения должен быть непрерывным. В опытах наблюдается линейчатый спектр излучения атомов. Кроме того, непрерывное излучение уменьшает энергию электрона, и он из-за уменьшения орбиты обязан был бы упасть на ядро.
Постулаты Нильса Бора
Нильс Бор «спас» планетарную модель для атома водорода, сформулировав три постулата.
I постулат: атом может находиться не во всех состояниях, допускаемых классической физикой, а только в особых квантовых (или стационарных) состояниях, каждому из которых соответствует своя определенная энергия Еп. В стационарном состоянии атом
не излучает.
II постулат: при переходе атома из одного стационарного состояния в другое излучается или поглощается квант света с энергией ħω, равной разности энергий стационарных состояний: 
III постулат: в стационарном состоянии электрон может двигаться только по такой «разрешенной» орбите, радиус которой удовлетворяет условию:
mυr=mħ, где тυ- импульс электрона,
n - номер квантового состояния (n= 1,2,3...).
Согласно этим постулатам, энергия атома водорода в n-м стационарном состоянии определяется формулой: 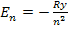 ,
,
Где Ry= 2.18 ·10-18 Дж = 13,6 эВ - внесистемная единица энергии, называемая ридбергом.
Главное квантовое число - целое число n, определяющее номер квантового состояния и энергию атома в этом состоянии.
Энергетический уровень - значение энергии атома в том или ином стационарном состоянии.
п = 1 - нормальное (основное) состояние атома.
п > 1 - возбужденные состояния.
При переходе с более высокого энергетического уровня на более низкий происходит излучение кванта света:
ω= 
где  - энергия атома в начальном состоянии;
- энергия атома в начальном состоянии;
 - энергия атома в конечном состоянии.
- энергия атома в конечном состоянии.
При обратном переходе, из состояния более низкого уровня в более высокий, происходит поглощение кванта: ω= 
Недостатки теории Бора.
1)Не смогла объяснить интенсивность спектральных линий.
2)Справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева.
3)Теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно — уравнение движения электрона — классическое, другое — уравнение квантования орбит — квантовое.
Теория Бора являлась недостаточно последовательной и общей. Поэтому она в дальнейшем была заменена современной квантовой механикой, основанной на более общих и непротиворечивых исходных положениях. Сейчас известно, что постулаты Бора являются следствиями более общих квантовых законов. Но правила квантования типа широко используются и в наши дни как приближенные соотношения: их точность часто бывает очень высокой.
8. Ри́дберговские а́томы — атомы, в которых один из электронов внешней оболочки находится в высоковозбужденном состоянии. Обычно, это атомы щелочной группы элементов (литий, натрий, рубидий и т. д.), у которых рыхлая внешняя электронная оболочка как раз и состоит из одного электрона. Воздействуя на такой атом лазерным светом определенной длины волны, удается возбуждать внешний электрон в состояния с главным квантовым числом n вплоть до n ~ 1000.
Свойства ридберговских атомов
Основные свойства ридберговских атомов можно увидеть уже из простого квазиклассического описания. Энергия связи такого водородоподобного атома равна Wn = Ry /(n-δ)2, где Ry = 13.6 эВ (есть Ридберг), а δ дефект заряда ядра, который при больших n несуществен. Разница энергий между n -м и n+1 -м уровнями энергии примерно равна

Характерный размер атома rn и типичный квазиклассический период обращения электрона равны

где aB = 0.5·10-10 м — боровский радиус, а T1 ~ 10-16 с.