
Азотсодержащие гетероциклические соединения проявляют основные свойства. Кроме того, гетероциклы подобно бензолу, обнаруживают ароматический характер; циклы гетероциклических соединений лежат в основе многих биологически активных веществ и лекарственных соединений.
Задача № 2. В каких биологически важных системах встречается пиррольний цикл? Роль в жизнедеятельности этих систем.
Эталон решения. Большое биологическое значение имеют тетрапиррольные соединения, в состав которых входят четыре пиррольних кольца, причем два из них находятся в изоформе:

Эти четыре кольца образуют замкнутую сопряженную систему –называемую порфином:

Порфин содержит 26 делокализованных электронов, весь цикл лежит в одной плоскости и обладает значительной устойчивостью, не разрушаясь даже при нагревании до температуры 3500С. Порфин, который содержит заместители в пиррольних циклах, называется порфирином. Примером порфирина является протопорфирин, в котором заместителями выступают метильные и винильные радикалы, а также остатки пропионовой кислоты.
Порфирин в природе образует комплексы с металлами. Если комплексообразователем является Fе2+, то порфирин называется гемом и составляет небелковую часть (простетическую группу) гемоглобина.
Конденсированния система из бензольного и пиррольного циклов (индол) входит в состав незаменимой аминокислоты – триптофана.

Первый путь биохимических превращений триптофана – гидроксилирование с образованием 5-гидрокситриптофана, который далее подвергается декарбоксилированию, давая 5-гидрокситриптамин (серотонин).

Второй путь метаболизма триптофана – превращение в b-индолилуксусную кислоту:
|




|
|
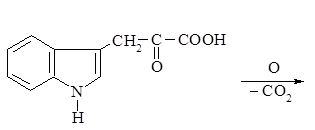
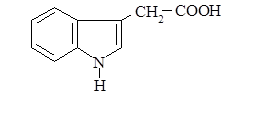
Гетероауксин является гормоном роста растений, оказывает большое влияние на развитие корневой системы.
Задача № 3. В какие физиологически важные системы входит имидазол? Амфотерность имидазола.
Эталон решения. Имидазольний цикл входит в состав гистидина – одной из аминокислот, которые образуют белки.

В организме имидазол в составе гистидина принимает участие в ряде ферментативных реакций, проявляя свойства донора и акцептора протонов. Эти его свойства обусловлены разным состоянием атомов азота, которые образуют цикл. Один из них (1) – пиррольный, неподеленная пара электронов которого вступает в сопряжение с π-электронами кольца. Второй (3) – пиридиновый, принимает участие в сопряжении одним р-электроном, а за счет спаренных электронов может присоединять протон, проявляя основные свойства. Имидазол образует соли как с минеральными, так и с некоторыми органическими кислотами:

За счет пиррольного азота имидазол проявляет кислотные свойства, так как связь N-Н поляризована и возможно отщепление протона (N-H кислотность). Имидазол является более сильной кислотой, чем пиррол, поскольку пиридиновый азот действует как электроноакцепторный заместитель, увеличивая поляризацию N-H связи:

Амфотерный характер имидазола обусловливает его участие в реакциях в виде аниона или катиона, то есть способность выступать в качества донора и акцептора протонов.
Замещенные гетероциклические кольца пиримидина и тиазола входят в состав тиамина (витамина В1). В организме дифосфат тиамина является коферментом (кокарбоксилаза), который принимает участие в декарбоксилировании пировиноградной кислоты.
Задача № 4. Какая роль производных пиридина в окислительно-восстановительных реакциях в организме?
Эталон решения. Из производных пиридина очень важны пиридинкарбоновые кислоты. β-пиридинкарбоновая (никотиновая) кислота, ее амид (никотинамид), известны как две формы витамина РР, недостаток которого в организме вызывает пеллагру. Никотинамид входит в состав кофермента НАД+, который катализирует окислительно-восстановительные процессы. Его каталитическое действие связано с нуклеофильными свойствами пиридинового азота. Так при действии на пиридин и никотинамид галогеналкилов образуются четвертичные соли метилпиридиния:

В организме метиллирующим агентом является активированная форма a-аминокислоты метионина.
Катион, который образовался, за счет положительного заряда на атоме азота становится еще более электронодефицитным, причем наименьшая электронная плотностью имеет место в положении 4 пиридинового ядра. Именно в этом положении проходит нуклеофильная атака при взаимодействии с гидрид-ионом:

В результате этой реакции катион присоединяет электронную пару гидрид-иона. При этом кольцо теряет ароматичность, переходя в состояние с большей энергией. При обратной реакции осуществляется окисление и энергия, которая при этом выделяется, тратится на биохимические процессы.

В организме при участии НАД+ происходит окисление гидроксилсодержащих соединений (например, изолимонной кислоты в щавелевоянтарную в цикле Кребса).
В данном случае дегидрирование осуществляется с отделением гидрид иона и протона. Гидрид-ион присоединяется к НАД+, образовывая восстановленную форму НАДН.
Задача № 5. Какие таутомерные формы известны для мочевой кислоты? Биологическая роль мочевой кислоты.
Эталон решения. Мочевая кислота – конечный продукт метаболизма пуриновых соединений в организме. Она выделяется с мочой в количестве 0,5-1г. за сутки. Для всех гидроксипроизводных пурина характерна окси-оксотаутотомерия: (лактам-лактимная таутомерия).

Мочевая кислота малорастворима в воде. Она является двухосновной кислотой и поэтому может образовывать кислые и средние соли:

Соли мочевой кислоты называются уратами. Средние соли щелочных металлов хорошо растворяются в воде; кислые (кроме литиевых) – малорастворимые.
При некоторых нарушениях в организме соли мочевой кислоты откладываются в мочевом пузыре, почках, мочевыводящих путях в виде мочевых камней.
Пурин являет собой конденсируемую гетероциклическую систему, которая состоит из пиримидинового и имидазольного циклов. Пурин является родоначальником большой группы биологически важных соединений. Пуриновые основания – аденин и гуанин – компоненты нуклеиновых кислот.

Эти соединения образуются при распаде нуклеиновых кислот. В организме отсутствуют ферменты, которые катализируют процессы деструкции пуринового ядра.
Задача № 6. В состав каких лекарственных препаратов входит пиразол?
Эталон решения. Ядро производного пиразола – пиразолона-5 – лежит в основе группы ненаркотических анальгетиков: антипирина, амидопирина, анальгина, бутадиона:

Эти вещества применяются как обезболивающие, жаропонижающие и противовоспалительные средства.
Задача № 7. В каких биологически активных соединениях встречается хинолин?
Эталон решения. Ценную группу лекарственных препаратов составляют производные 8-гидроксихинолина (оксина). Энтеросептол (5-хлор-7-йод-8-гидроксихинолин) плохо всасывается из желудочно-кишечного тракта, поэтому оказывает антибактериальное действие в кишечнике и применяется для лечения дизентерии и колитов.
Нитроксалин (5-нитро-8-оксихинолин) быстро всасывается из желудочно-кишечного тракта и выводится через почки. Поэтому его применяют при инфекциях почек и мочевых путей.
В основе биологического действия препаратов 8-гидроксихинолинового ряда лежит их способность к образованию хелатных комплексов с ионами некоторых металлов (кобальта, магния и т.д.). Таким образом происходит связывание микроэлементов, необходимых для жизнедеятельности бактерий.
Вопросы и упражнения.
№ 1
1. Приведите строение пиразола, имидазола и пиррола. Объясните, почему они являются ароматическими соединениями. Сравните поведение имидазола и пиррола в кислой среде.
2. Приведите строение лекарственных соединений, включающих фрагмент амида никотиновой кислоты, – витамина РР. Применение никотинамида.
3. Напишите уравнения реакций, которые протекают с триптофаном (b-индолил- b-аминопропионовой кислотой). Назовите продукты реакций.
№ 2
1. Напишите уравнение реакции сульфирования. По какому механизму протекает реакция?
2. Напишите уравнение реакции декарбоксилирования никотиновой кислоты. Как определить, что реакция прошла?
3. Напишите лактим-лактамную таутомерию мочевой кислоты. Роль мочевой кислоты в обмене веществ.
№ 3
1. Опишите механизм нитрирования фурана.
2. Охарактеризуйте строение и применение производных изоникотиновой кислоты – тубазида и фтивазида.
3. Объясните причину кислотности барбитуровой кислоты и ее производных – барбитала и фенобарбитала. Применение препаратов.
№ 4
1. Напишите уравнение качественной реакции антипирина с азотистой кислотой.
2. Приведите строение пиридина, пиримидина, и пурина. Укажите нумерацию атомов. Объясните, почему эти соединения являются ароматическими.
3. Приведите примеры растворимой и нерастворимой солей мочевой кислоты.
№ 5
1. Напишите уравнение качественной реакции антипирина с азотистой кислотой.
2. Чем объясняется способность пиридина и пиримидина взаимодействовать с соляной кислотой?
3. Приведите строение биогенных аминов – триптамина (b-индолилэтиламина) и серотонина (5-окситриптамина). Какая гетероциклическая структура является их основой?
№ 6
1. Напишите уравнение реакции взаимодействия антипирина с йодом. По какому механизму проходит эта реакция?
2. Напишите уравнение реакции взаимодействия пиридина с бромистым метилом. По какому механизму протекает реакция?
3. Приведите структуры таутомеров ксантина (2,6-диоксопурина). В состав каких лекарственных препаратов входит ядро ксантина?
№ 7
1. Напишите формулу амидопирина. Применение препарата.
2. Напишите уравнение реакции образования никотинамида из с никотиновой кислоты. Применение никотинамида в медицинской практике.
3. Приведете лактам – лактамную таутомерию барбитуровой кислоты. Какой вид таутомерии обусловливает кислотные свойства барбитуровой кислоты?
№ 8
1. Какие особенности гистидина обусловливают его кислотно-основные свойства?
2. Напишите уравнение реакции взаимодействия никотиновой кислоты с раствором щелочи при нормальных условиях и при нагревании. Какие продукты образуются?
3. Приведите строение индола. В состав каких биологически активных соединений входит индол?
№ 9
1. Напишите схему получения амидопирина из антипирина.
2. Какой процесс лежит в основе получения кофермента НАД+? Напишите схему реакции.
3. Приведите уравнения реакций, которые подтверждают основные свойства хинолина.
№ 10
1. Напишите структуру порфина. В состав каких биологически важных соединений входит порфин?
2. Напишите уравнение реакции гидрирования пиридина. Назовите образованное соединение. В каких лекарственных препаратах содержится гидрированный пиридин?
3. Приведите структуры лекарственных препаратов, в состав которых входит ядро 8-гидроксихинолина. Применение этих лекарственных средств.
№ 11
1. Напишите уравнение реакции декарбоксилирования триптофана.
2. Напишите строение фтивазида. При каких заболеваниях он применяется.
3. Напишите таутомерные формы гипоксантина. Нумерация атомов в ядре.
№ 12
1. Какие производные пиразола нашли применение в медицине. Напишите структуры.
2. Напишите уравнение реакции получения йодистого метилпиридиния и реакцию его взаимодействия с гидрид- ионом. Значение этой реакции.
3. Напишите структуру лактамной формы мочевой кислоты. Роль мочевой кислоты в физиологии организма.
№ 13
1. Напишите уравнение качественной реакции на антипирин, применение препарата.
2. Напишите схему реакции получения гидразида изоникотиновой кислоты, применение соединения.
3. Напишите структуру пиримидиновых оснований, которые входят в состав нуклеиновых кислот.
№ 14
1. Напишите уравнение реакции полного и неполного гидрирования пиррола. Механизм реакции.
2. Напишите уравнение реакции взаимодействия пиридина с хлоридом железа (ІІІ). Какое вещество выпадает в осадок?
3. Напишите уравнение реакции образования барбитуровой кислоты. В состав каких лекарственных средств она входит? Применение этих препаратов.
№ 15
1. Напишите уравнение реакции сульфирования тиофена. По какому механизму протекает реакция?
2. Напишите уравнение реакции получения йодистого метилпиридиния. Какое соединение пиридин или метилпиридиниевый катион легче вступает в реакцию нуклеофильного присоединения и почему? В состав которого кофермента входит алкилпиридиневый ион?
3. В состав каких нуклеиновых кислот входит пурин? Приведите приводите нумерацию атомов в ядре и структуры соединений.
Тема ІІ. НУКЛЕИНОВЫЕ КИСЛОТЫИ ИХ КОМПОНЕНТЫ