Конспект урока по физике
Дата: 8.06. 2020
| 28.05 | 8.06 |
Группа № 4 специальность «Техническая эксплуатация подъемно-транспортных, строительных, дорожных машин и оборудования», 1 курс
Тема: «Теория строения атома водорода по Бору».
Форма работы: индивидуальная, электронное обучение
Тип урока: урок изучения нового материала
Цель урока: изучить квантовые постулаты Бора и объяснить на их основе линейчатый спектр водорода, сформулировать квантовые постулаты Бора; изучить понятия: энергетический уровень, энергия ионизации, спонтанное излучение света, вынужденное излучение света.
Используемая литература: Мякишев Г.Я., Буховцев Б.Б., Чаругин В.М. Физика 11 класс, Издательство Просвещение, 2018
https://uchebnikionline.ru/uchebniki/11-klass/fizika-11-klass-myakishev-buhovcev-charugin
Интернет-ресурсы: презентация на тему «Квантовые постулаты Бора»
https://resh.edu.ru/subject/lesson/5908/start/197851/
Ход работы
1. Организационный этап. Здравствуйте, ребята! На этом уроке мы изучим новую тему: «Квантовые постулаты Бора».
Основной этап
Изучение нового материала
Квантовые постулаты Бора – предположения (утверждения), сделанные Н. Бором для того, чтобы модель строения атома Резерфорда соответствовала реальному поведению атомов водорода;
Правило квантования орбит – правило, по которому электрон движется по орбитам, момент импульса которых равен целому числу постоянной планка (с чёрточкой); главное квантовое число – целое число, равное соответствующему номеру состояния атома; для основного состояния n = 1;
Энергетические уровни – уровень энергии для каждого значения главного квантового числа, начиная с 1 (единицы): Е1, Е2, Е3 и т.д.;
Индуцированное излучение – излучение возбуждённых атомов, вызванное действием другого (индуцирующего) излучения;
Лазер – устройство, в котором производится (генерируется) индуцированное когерентное излучение
Модель атома Резерфорда противоречит классической электродинамике Максвелла. Выход из сложившейся ситуации был найден Нильсом Бором. В 1913 году он дополнил модель Резерфорда двумя постулатами, называемыми квантовыми постулатами Бора.
Первый постулат Бора (постулат стационарных состояний):
В атоме существуют стационарные орбиты, двигаясь по которым электрон не излучает.
Второй постулат (правило частот): Излучение и поглощение энергии происходит при переходе электрона с одной стационарной орбиты на другую.
Энергия излучённого или поглощённого фотона равна разности энергий стационарных состояний
hvkn = Ek - En;
Частота излучения равна:
vkn = (Ek - En) / h
Или, длина волны излучения λ равна:
λkn = hc / (Ek - En), где h – постоянная Планка, с – скорость света в вакууме.
Если Ek > En, то происходит излучение фотона, если Ek < En, то происходит поглощение фотона, при котором атом переходит из одного стационарного состояния в другое. Энергия электрона, как и скорость и радиус орбиты, принимают дискретный набор значений, т. е. квантуются. Расчеты частот переходов с энергетических уровней для атома водорода дают значения, совпадающие с экспериментальными величинами спектра водорода.
Используя понятие энергетических уровней в атомах было открыто явление индуцированного излучения. Это явление используется в лазерах, устройствах, которые дают индуцированное излучение в различных диапазонах электромагнитного излучения.
Ядро атома водорода имеет положительный заряд, который по модулю равен заряду электрона, и массу, примерно в 1836,1 раза больше массы электрона.
Размер атома водорода — это радиус орбиты его электрона
Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование. Она кажется совершенно необходимой для объяснения опытов по рассеиванию α-частиц. Но на основе этой модели нельзя объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением. Ускоренно движущийся заряд должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Электроны должны приближаться к ядру, подобно тому как спутник приближается к Земле при торможении в верхних слоях атмосферы. Атом должен прекратить свое существование. В действительности ничего подобного не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны
В начале XX века было уже известно, что вещество излучает свет конкретных длин волн в определенных, очень узких спектральных интервалах - спектральных линиях, все линии имеют конечную длину.
Линейчатые спектры дают все вещества в газообразном атомарном (но не молекулярном состоянии). Классическим примером линейчатого спектра является спектр атома водорода.
Швейцарский физик и математикИоганн Якоб Бальмер определил, что в видимой части спектра атома водорода имеются четыре линии, соответствующие длинам волн: λ1 = 434 нм; λ2 = 486 нм; λ3 = 410 нм; λ4 = 656 нм
Частота излучений атома водорода составляет ряд серий, каждая из которых образуется в процессе перехода атома в одно из энергетических состояний, переходов электрона с верхних энергетических уровней на нижние уровни. На рисунке можно увидеть переходы электрона на другой энергетический уровень, частоты излучения которого находятся в видимой области спектра.
Серию уровней назвали в честь швейцарского учителя Иоганна Бальмера, который ещё в 1885 году основываясь на результатах экспериментов вывел формулу для определения частот видимой части спектра водорода:

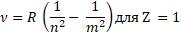
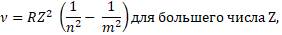
где Z – число протонов в атоме или порядковый номер в периодической таблице Менделеева;
n и m (целое число – 1, 2, 3, 4, 5, и так далее) - энергетические уровни, где m > n.
В этой формуле v — не частота, которая измеряется в с-1, а волновое число, которое равно обратному значению длины волны 1/λ и которое измеряется в м-1.

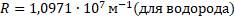
R — это постоянная Ридберга (для данного вещества), которая определена из спектральных данных, учитывая, что скорость распространения видимого излучения составляет: 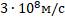
Не согласующийся с опытом вывод о неизбежной гибели атома вследствие потери энергии на излучение — это результат применения законов классической физики к явлениям, происходящим внутри атома. Отсюда следует, что к таким явлениям законы классической физики неприменимы. Все выводы об устойчивости атома и спектре, которые излучает атом будут подтверждены Нильсом Бором в 1913 году.