Существует много систем классификации экстракционных процессов и методов экстракции.
В зависимости от строения экстрагируемых соединений экстракционные процессы подразделяют на следующие группы:
1. Простые вещества с ковалентной связью: GeCl4, HgI2, AsI3. Экстракция не сопровождается изменением химической формы (простое физическое распределение).
2. Внутрикомплексные соединения.
3. Ионные ассоциаты.
4. Координационно-несольватированные соли, например, соли тетрафениларсония, которые вследствие больших размеров не имеют координационных связей с молекулами воды.
5. Минеральные кислоты, которые экстрагируются полярными растворителями с достаточно высокой основностью: простыми и сложными эфирами, кетонами, спиртами, аминами и их оксидами, солями четвертичных аммониевых оснований.
6. Комплексные металлокислоты (HFeCl4, H2CdI4). Экстракция проводится кислородсодержащими растворителями, солями органических оснований. Они хорошо извлекаются в макро- и микроколичествах. Это позволяет переводить в органическую фазу микроэлементы и матрицу.
7. Координационно-сольватированные нейтральные (смешанные) комплексы типа SсCl3(ТБФ)3 и др. Они содержат во внутренней сфере атом металла, неорганический анион и молекулы экстрагента. Соединения такого типа лучше всего извлекаются высокоосновными растворителями, способными к координации с металлом.
8. Гетерополисоединения, например, H3[P(Mo3O10)4], H3[As(Mo3O10)4], H4[Si(Mo3O10)4], H4[Ge(Mo3O10)4] и др. Они экстрагируются кислородсодержащими органическими растворителями. Их используют при концентрировании мышьяка, молибдена, германия, вольфрама, ванадия и др. элементов.
9. Разные соединения: внешнесферные галогениды и псевдогалогениды типа [Са(ТБФ)m2+]·(SCN)2.
Экстракционные системы можно разделить на три типа:
♦ экстракция катионных форм;
♦ экстракция анионных форм;
♦ экстракция простых неионизированных молекул.
Экстракция внутрикомплексных соединений. Важными стадиями процесса экстракции являются:
♦ распределение органического реагента между фазами,
♦ распределение внутрикомплексных соединений.
Распределение органического реагента. Данные о распределении реагента являются необходимыми при обработке результатов по экстракции металлов в виде внутрикомплексных солей. Для экстракции чаще всего применяют реагенты, которые являются слабыми кислотами, с константами диссоциации меньше 10-3-10-4. Число кислотных групп может быть различным.
Дентатность реагента тоже может быть разной, но большинство реагентов являются бидентатными. Наиболее распространенные реагенты, применяемые для экстракции внутрикомплексных соединений, представляют собой одноосновные и бидентатные слабые кислоты. Примерами могут быть ацетилацетон, бензоилфенилгидроксиламин, 8-оксихинолин, диэтилдитиокар-баминовая кислота. Находят применение также двухосновные и тетрадентатные органические кислоты, типичными примерами которых может быть азо-азокси БН (2-(2-оксинафталин)1-азо-2)фенилазокси-4-метилфенол). Распределение реагента может происходить в виде нейтральных молекул, однако в ряде экстракционных систем, особенно при экстракции из солевых растворов и при использовании кислородсодержащих растворителей, создаются условия для экстракции ассоциатов с разными ионами. Если реагент НА не амфотерный, то происходит экстракция аниона А в виде ионных ассоциатов с присутствующими в системе катионами, например, натрием или аммонием. Если реагент амфотерный, то, кроме аниона А-, может извлекаться катион Н2А+, образующий ионные ассоциаты с перхлоратами, хлоридами и др. Возможность экстракции заряженных форм определяется несколькими факторами, из которых особенно выделяют следующие: природа растворителя, природа присутствующего в растворе противоиона (например, перхлората или сульфата, натрия, калия или аммония) и концентрация этого противоиона, или ионная сила раствора. Так, экстрагирующийся из перхлоратных растворов метилизобутилкетоном 8-оксихинолиний не извлекается хлороформом, метилизобутилкетон не извлекает этот катион из хлоридных растворов, а константа распределения Н2ОхClO4 выше при использовании 0,5 М растворов перхлората, чем при использовании 0,1 М растворов. Исследования по извлечению всех форм 8-оксихинолина в широком интервале рН изоамиловым спиртом, показали, что в зависимости от среды раствора возможна экстракция реагента в молекулярной, анионной и катионной форме.
При распределении реагента между водным раствором и органическим растворителем при постоянной ионной силе и постоянной температуре могут иметь место следующие равновесия.
Н2А+  Н+ + НА
Н+ + НА 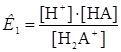 (1)
(1)
НА  Н+ + А-
Н+ + А- 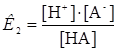 (2)
(2)
НА  НА(О)
НА(О) 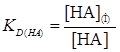 (3)
(3)
А-  А
А 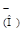
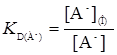 (4)
(4)
Н2А+  Н2А
Н2А 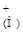
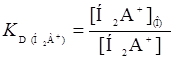 (5)
(5)
Коэффициент распределения реагента можно записать в виде
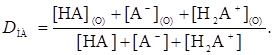 (6)
(6)
Выразив в этом уравнении все концентрации через концентрации водородных ионов и константы, заданные уравнениями (1-5), путем простых преобразований, получим
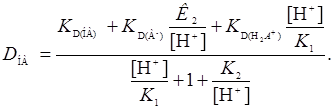 (7)
(7)
Это основное уравнение для коэффициента распределения реагента. Пользуясь им, можно определить и значения констант распределения ионов реагента, т.е. 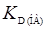 ,
, 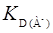 ,
, 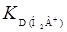 .
.
В зависимости от условий экстракции уравнение (7) несколько упрощается. При низких значениях рН в знаменателе этого уравнения можно оставить первый член, а в числителе первый и последний (остальные очень малы по величине). Получим
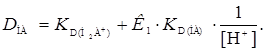 (8)
(8)
Это уравнение представляет собой уравнение прямой. Отложив на графике экспериментальные значения 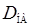 в зависимости от
в зависимости от 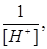 можно получить прямую, отсекающую на оси ординат величину, равную
можно получить прямую, отсекающую на оси ординат величину, равную 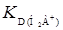 . Тангенс угла наклона прямой равен
. Тангенс угла наклона прямой равен 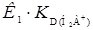 . При высоких значениях рН можно сохранять только последний член, а в числителе – два первых. Получим
. При высоких значениях рН можно сохранять только последний член, а в числителе – два первых. Получим
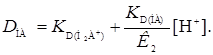
Если реагент не амфотерный (К 1 = 0, К 2 = К НА) из уравнения (7) имеет
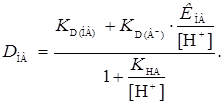 (9)
(9)
Для амфотерного реагента, если экстракция А- и Н2А+ практически отсутствует (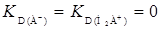 ) из уравнения 7, коэффициент распределения представляем уравнением
) из уравнения 7, коэффициент распределения представляем уравнением
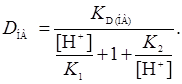 (10)
(10)
Если протонизацией реагента можно пренебречь, т.е., если заряженные формы не экстрагируются, коэффициент распределения находим по формуле
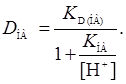 (11)
(11)
Этому уравнению отвечает зависимость lg D от рН. При относительно низких рН знаменатель уравнения стремится к единице, и в этих условиях D НА= КD ( НА).
Для определения константы экстракции внутрикомплексного соединения часто приходится вычислять концентрацию молекулярной формы реагента в органической фазе. Общую концентрацию реагента в системе представим следующим образом:
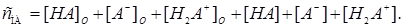 (12)
(12)
Отсюда искомая концентрация равна
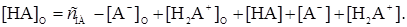 (13)
(13)
После нескольких преобразований, используя уравнения (1-5), получаем уравнение
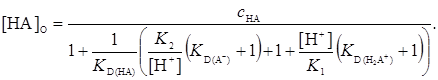 (14)
(14)
Если заряженные формы не экстрагируются, уравнение упрощается
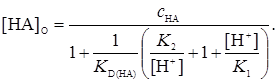 (15)
(15)
Для определения констант устойчивости комплексов необходимо знать концентрацию аниона реагента в водной фазе. Концентрацию аниона найдем из уравнения (12), выразив концентрацию в правой части уравнения через константы, заданные уравнениями (1-5), через концентрацию водородных ионов и А-.
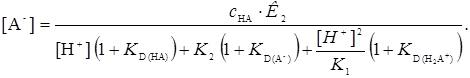 (16)
(16)
Это уравнение, по-видимому, является наиболее общим для концентрации аниона реагента в водной фазе (при равном объеме равновесных фаз, как и все другие уравнения). Если А- и Н2А- не экстрагируются, можно пользоваться более простым уравнением
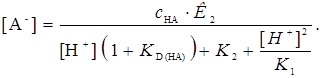 (17)
(17)
В случае неамфотерного реагента, если 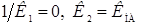 , но анион А- может экстрагироваться, получим уравнение
, но анион А- может экстрагироваться, получим уравнение
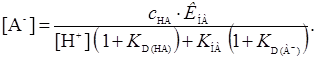 (18)
(18)
Если реагент не амфотерный и заряженные формы его не экстрагируются, т.е. в наиболее простом случае, уравнение (16) имеет следующий вид
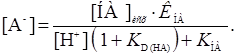 (19)
(19)
Если при экстракции применяется реагент, представляющий собой двухосновную кислоту, при распределении реагента между водной и органической фазами имеют место следующие равновесия:
Н2А  Н+ + НА-
Н+ + НА- 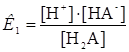 (20)
(20)
НА-  Н+ + А2-
Н+ + А2- 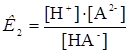 (21)
(21)
Н2А  Н2А(О)
Н2А(О) 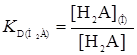 (22)
(22)
НА-  НА
НА 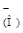
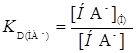 (23)
(23)
А2-  А
А 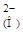
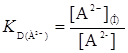 (24)
(24)
Уравнение коэффициента распределения реагента, выведенное аналогично уравнению (7), имеет следующий вид:
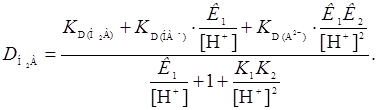 (25)
(25)
При отсутствии заряженных форм уравнение упрощается
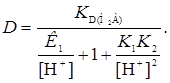 (26)
(26)
Из уравнения (25) и (26) видно, что чем выше рН водной фазы, тем ниже коэффициент распределения и тем больше концентрация реагента в водной фазе. При понижении рН концентрация реагента в водной фазе уменьшается и при определенном, достаточно низком значении рН будет соответствовать распределению молекулярной формы реагента. В этом случае 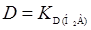 . При низких значениях рН, когда реагент в водной фазе диссоциирует по 1-ой ступени в уравнении (25), главную роль играет первый член знаменателя и первый и второй – числителя. В этом случае имеем
. При низких значениях рН, когда реагент в водной фазе диссоциирует по 1-ой ступени в уравнении (25), главную роль играет первый член знаменателя и первый и второй – числителя. В этом случае имеем
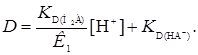 (27)
(27)
Это уравнение представляет собой уравнение прямой, где отношение 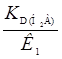 – угол наклона,
– угол наклона, 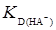 – отрезок, который отсекается на оси ординат прямой. При высоких значениях рН, когда диссоциация реагента проходит по второй ступени, в уравнении (25) играет роль второй член знаменателя и первый и третий числителя. В этом случае уравнение (27) представляет собой уравнение параболы
– отрезок, который отсекается на оси ординат прямой. При высоких значениях рН, когда диссоциация реагента проходит по второй ступени, в уравнении (25) играет роль второй член знаменателя и первый и третий числителя. В этом случае уравнение (27) представляет собой уравнение параболы
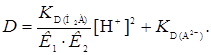 (28)
(28)
и 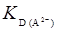 – это отрезок на оси ординат, который отсекается кривой. Таким образом, если экспериментальные данные выразить в координатах [Н+] – D, можно определить
– это отрезок на оси ординат, который отсекается кривой. Таким образом, если экспериментальные данные выразить в координатах [Н+] – D, можно определить 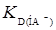 и
и 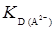 . Концентрация в водной фазе анионных форм реагента НА- и А2-, если они экстрагируются, определяется уравнениями
. Концентрация в водной фазе анионных форм реагента НА- и А2-, если они экстрагируются, определяется уравнениями
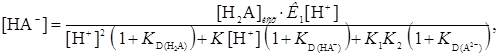 (29)
(29)
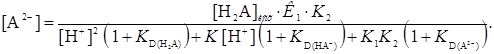 (30)
(30)
При отсутствии экстракции анионов эти уравнения упрощаются
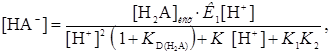 (31)
(31)
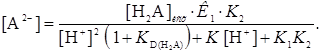 (32)
(32)
Концентрация в органических фазах молекулярной формы реагента, являющегося двухосновной кислотой, характеризуется уравнением
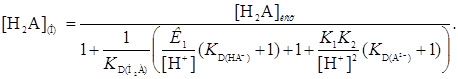 (33)
(33)
При отсутствии экстракции анионных форм реагента уравнение имеет вид
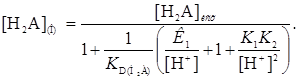 (34)
(34)
Все уравнения, которые характеризуют распределение реагентов между водной и органической фазами, показывают, что при прочих равных условиях распределение реактива зависит только от значения рН водного раствора. С повышением рН уменьшается концентрация молекулярной формы реагента в органической фазе и увеличивается концентрация анионных форм реагента в водной фазе.
Распределение внутрикомплексных соединений. Экстракцию внутрикомп-лексных соединений можно представить следующим образом. Ион металла Мn+ взаимодействует с органическими реагентами НА с образованием незаряженного внутрикомплексного соединения МАn, которое распределяется между двумя фазами. Этот процесс может быть представлен уравнением
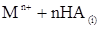

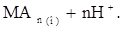
Константа равновесия этой реакции, называемая константой экстракции, определяется уравнением
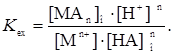 (35)
(35)
При постоянной температуре константа экстракции для данной системы зависит от ионной силы водной фазы. Константы экстракции имеют практическую ценность для определения коэффициентов распределения, подбора экстрагента, подбора условий (рН, концентрация органического реагента). Кроме того, сопоставляя константы экстракции различных металлов, можно получить представление о последовательности экстракции металлов данным экстрагентом. Если рассматривается область рН, где можно пренебречь образованием в водной фазе промежуточных комплексов, гидроксокомплексов и продуктов реакций с посторонними комплексообразующими веществами, и если пренебречь существованием в этой фазе комплекса МАn, то отношение [МАn]:[Мn+] из уравнения (35) можно считать коэффициентом распределения. Тогда
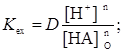
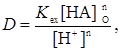 (36)
(36)
или
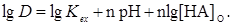 (37)
(37)
Это основное уравнение, описывающее экстракцию хелата.
Из уравнения (37) видно, что, если концентрация органического реагента поддерживается постоянной, распределение металла является функцией одного лишь значения рН. Зависимость lg D от рН выражается прямой линией с наклоном, равным n (рис. 4).
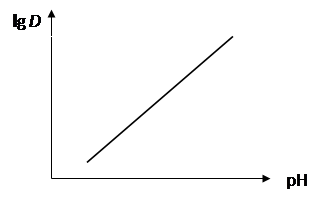
Рис. 4. Зависимость коэффициента распределения металла в виде хелата от равновесного значения рН при постоянной концентрации реагента в органической фазе
По мере повышения рН в водной фазе, кроме иона Мn+, появляются низшие неэкстрагируемые комплексы с реагентом, например 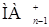 , и, наконец,
, и, наконец, 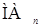 . Поэтому зависимость начинает отклоняться от прямой в той области, где в обеих фазах существвует
. Поэтому зависимость начинает отклоняться от прямой в той области, где в обеих фазах существвует 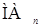 , выходит на плато. При еще более высоких рН сказывается гидролиз металла, иногда образование анионных комлексов металла с реагентом типа
, выходит на плато. При еще более высоких рН сказывается гидролиз металла, иногда образование анионных комлексов металла с реагентом типа 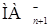 , – в результате экстракция падает (рис. 5).
, – в результате экстракция падает (рис. 5).
Для различных элементов зависимость экстракции от рН при использовании одного и того же реагента часто не одинакова. Это имеет большое значение, так как, регулируя рН экстракции, можно эффективно разделять элементы (рис. 6, 7).
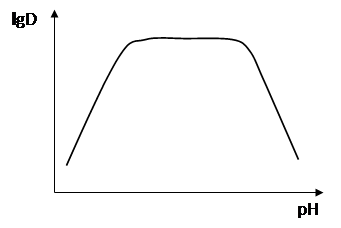
Рис. 5. Зависимость коэффициента распределения металла от равновесного значения рН водной фазы
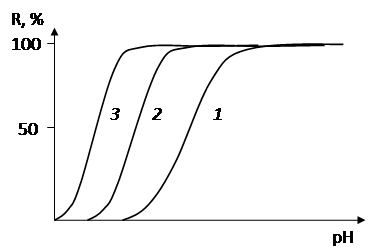
Рис. 6. Зависимость степени извлечения хелатов ионов металлов с различными зарядами z от рН водной фазы: z = 1 (1), 2 (2), 3 (3)
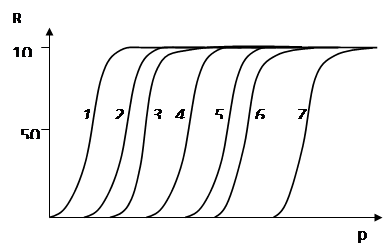
Рис. 7. Зависимость извлечения дитизонатов металлов от рН водной фазы: Hg(II) (1), Cu(II) (2), Bi(III) (3), Sn(II) (4), Pb(II) (5), Zn (6), Cd (7)
В данной экстракционной системе (элемент – реагент – растворитель) коэффициент распределения зависит от равновесной концентрации реагента в органической фазе (уравнение 37). При постоянном значении рН водной фазы наблюдается линейная зависимость логарифма коэффициента распределения от равновесной концентрации реагента (рис. 8).
|
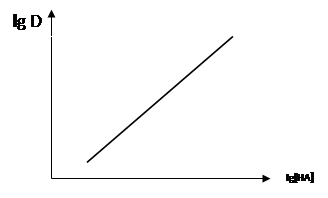
Рис. 8. Зависимость коэффициента распределения металла в виде хелата от равновесной концентрации реагента в органической фазе при постоянном значении рН водной фазы
С увеличением концентрации реагента экстракция увеличивается и при этом экстракция возможна в более кислой среде, что имеет в практике большое значение. Однако концентрацию реагента нельзя повышать беспредельно. Повышение концентрации реагента ограничивается его растворимостью, кроме того, в некоторых случаях большой избыток реагента нежелателен. Например, следует избегать значительного избытка реактива в спектрофотометрических и спектральных методах анализа, если реагент поглощает в этой же области спектра, что и внутрикомплексное соединение, так как реагент нелегко удалить, а его остатки снижают точность определения.
Следует отметить, что интервал полной экстракции металла обычно совпадает с интервалом, в котором данное внутрикомплексное соединение осаждается. Однако эти интервалы могут и не совпадать, так как, кроме констант устойчивости они определяются произведением растворимости и константой распределения, которые зависят от разных факторов.
Константа экстракции зависит от константы устойчивости экстрагируе-мого соединения (βn), константы диссоциации реагента (К НА), константы распределения комплекса (КD , МА) и константы распределения реагента (КD , НА):
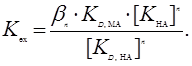
Экстракция тем лучше, чем выше устойчивость комплекса и чем больше его константа распределения. Экстракция тем выше, чем более сильной кислотой является реагент и чем меньше он сам переходит в органическую фазу.
Таким образом, на экстракцию внутрикомплексных соединений оказывают влияние константа диссоциации и константа распределения органического реагента, устойчивость внутрикомплексных соединений, присутствие маскирующих агентов, солей-электролитов, концентрация элемента, температура, природа растворителя, различные кинетические факторы.
Литература
1. Золотов Ю.А. Экстракция внутрикомплексных соединений / Ю.А. Золотов. – М.: Наука, 1968. – 225 с.
2. Золотов Ю.А. Основы аналитической химии Т.1 / Ю.А. Золотов. – М.: «Академия», 2010. – 384 с.