ПОЛИМИЕЛИТ
Полиомиелит — острое лихорадочное заболевание, которое иногда сопровождается поражением серого вещества (от греч. polios — серый) спинного мозга и ствола головного мозга, в результате чего развиваются вялые параличи и парезы мышц ног, туловища, рук.
Таксономия. Полиомиелит известен с глубокой древности. Возбудитель полиомиелита относится к семейству Picornaviridae роду Enterovirus виду Enterovirus С.
Структура и антигенные свойства. По структуре полиовирусы — типичные представители рода Enterovirus. Различают три серотипа полиовирусов: 1, 2,3, не вызывающие перекрестного иммунитета. Все серотипы патогенны для обезьян, у которых возникает заболевание, сходное по клиническим проявлениям с полиомиелитом человека.
Патогенез и клиника. Естественная восприимчивость человека к вирусам полиомиелита высокая. Входными воротами служат слизистые оболочки верхних дыхательных путей и пищеварительного тракта. Первичная репродукция вирусов происходит в лимфатических узлах глоточного кольца и тонкой кишки. Это обусловливает обильное выделение вирусов из носоглотки и с фекалиями еще до появления клинических симптомов болезни. Из лимфатической системы вирусы проникают в кровь (виремия), а затем в ЦНС, где избирательно поражают клетки передних рогов спинного мозга (двигательные нейроны).В результате этого возникают параличи мышц. В случае накопления в крови вируснейтрализующих антител, блокирующих проникновение вируса в ЦНС, ее поражения не наблюдается.
Инкубационный период продолжается в среднем 7–14 дней. Различают три клинические формы полиомиелита: паралитическую (1% случаев), менингеальную (без параличей), абортивную (легкая форма). Заболевание начинается с повышения температуры тела, общего недомогания, головных болей, рвоты, болей в горле. Полиомиелит нередко имеет двухволновое течение, когда после
легкой формы и наступившего значительного улучшения развивается тяжелая форма болезни. Паралитическую форму чаще вызывает вирус полиомиелита серотипа 1.
Иммунитет. После перенесенной болезни остается пожизненный типоспецифический иммунитет. Иммунитет определяется в основном наличием вируснейтрализующих антител, среди которых важная роль принадлежит местным секреторным антителам слизистой оболочки глотки и кишечника (местный иммунитет). Эффективный местный иммунитет играет важнейшую роль в прерывании передачи ≪диких≫ вирусов и способствует вытеснению их из циркуляции. Пассивный естественный иммунитет сохраняется в течение 3–5 нед. после рождения ребенка.
Микробиологическая диагностика. Материалом для исследования служат кал, отделяемое носоглотки, при летальных исходах — кусочки головного и спинного мозга, лимфатические узлы.
Вирусы полиомиелита выделяют путем заражения исследуемым материалом первичных и перевиваемых культур клеток. О репродукции вирусов судят по цитопатическому действию. Идентифицируют (типируют) выделенный вирус с помощью типоспецифических сывороток в реакции нейтрализации в культуре клеток. Важное значение имеет внутривидовая дифференциация вирусов, которая позволяет отличить ≪дикие≫ патогенные штаммы от вакцинных штаммов, выделяющихся от людей, иммунизированных живой полиомиелитной вакциной. Различия между ≪дикими≫ и вакцинными штаммами выявляют с помощью ИФА, реакции нейтрализации цитопатического действия вируса в культуре клеток со штаммоспецифической иммунной сывороткой, а также ПЦР.
Серологический метод основан на использовании парных сывороток больных с применением эталонных штаммов вируса в качестве диагностикума. Содержание сывороточных иммуноглобулинов классов IgG, IgA, IgM определяют методом радиальной иммунодиффузии по Манчини.
Лечение. Патогенетическое. Применение гомологичного иммуноглобулина для предупреждения развития паралитических форм весьма ограниченно.
Эпидемиология и специфическая профилактика. Эпидемии полиомиелита охватывали в 1940–1950-х годах тысячи и десятки тысяч человек, из которых 10% умирали и примерно 40% становились инвалидами. Основной мерой профилактики полиомиелита является иммунизация. Массовое применение вакцины против полиомиелита привело к резкому снижению заболеваемости. Первая инактивированная вакцина для профилактики полиомиелита была разработана американским ученым Дж. Солком в 1953 г. Однако парентеральная вакцинация этим препаратом создавала лишь общий гуморальный иммунитет, не формировала местной резистентности слизистых оболочек ЖКТ и не обеспечивала надежной специфической защиты.
Естественно аттенуированные штаммы вирусов полиомиелита всех трех типов получил в 1956 г. А. Сэбин, а в 1958 г. М.П. Чумаков и А.А. Смородинцев разработали первую пероральную живую культуральную вакцину из трех серотипов штаммов Сэбина. Вакцину используют для массовой иммунизации детей, она создает стойкий общий и местный иммунитет. ВОЗ в 1988 г. приняла решение о глобальной ликвидации полиомиелита путем охвата прививками всего детского населения планеты. Под ликвидацией подразумевали прекращение заболеваний и искоренение вируса полиомиелита. Использование оральной полиовакцины привело к практически полному исчезновению случаев полиомиелита в развитых странах Европы и в Америке и резкому снижению заболеваемости в развивающихся странах. В России случаи полиомиелита не регистрируются с 1 июля 2002 г.
У живой полиомиелитной вакцины имеются некоторые недостатки, наиболее серьезным из которых является возникновение случаев вакциноассоциированного полиомиелита у привитых и у контактных лиц, инфицированных вирусами, выделяемыми привитыми детьми. Контактное инфицирование происходит обычно вирусом одного серотипа.
Показано, что у иммунокомпетентных лиц отсутствует длительное носительство полиовируса после вакцинации, в то время как у лиц с иммунодефицитами вакцинный штамм может выделяться в течение 7–10 лет. Риск развития вакциноассоциированного паралитического полиомиелита у лиц с иммунодефицитами, особенно с нарушениями В-клеточного иммунитета, выше, чем риск у иммунокомпетентных лиц.
Неспецифическая профилактика сводится к санитарно-гигиеническим мероприятиям: обеспечение населения доброкачественными водой, пищевыми продуктами, соблюдение личной гигиены; выявление больных и подозрительных на заболевание.
Коксаки А и В
Вирусы Коксаки — РНК-содержащие вирусы семейства Picornaviridae рода Enterovirus. Вирусы названы по населенному пункту в США, где они были впервые выделены. По патогенности для новорожденных мышей вирусы разделены на группы А и В (более 30 серотипов): вирусы Коксаки А вызывают диффузный миозит и очаговый некроз поперечно-полосатых мышц; вирусы Коксаки В —
поражение ЦНС, развитие параличей, некроз скелетной мускулатуры и иногда миокарда и др.
Вирусы Коксаки А вызывают у человека герпангину (герпетиформные высыпания на задней стенке глотки, дисфагия, лихорадка), пузырчатку в полости рта и конечностей, полиомиелитоподобные заболевания, диарею у детей; возможна сыпь.
Вирусы Коксаки В вызывают полиомиелитоподобные заболевания, энцефалит, миокардит, плевродинию (болезненные приступы в области груди, ли-хорадка, иногда плеврит).
Микробиологическая диагностика. Вирусологический метод: вирус выделяют из фекалий, отделяемого носоглотки, заражают культуры клеток HeLa, почек обезьян (Коксаки В, отдельные серотипы Коксаки А) или мышей-сосунков. Учитывают характер патологических изменений у зараженных мышей. Вирусы идентифицируют с помощью РТГА, РСК, РН, ИФА.
Иммунодефицит человека
Вирус иммунодефицита человека (ВИЧ) вызывает ВИЧ-инфекцию, заканчивающуюся синдромом приобретенного иммунодефицита (СПИД). СПИД характеризуется тяжелым поражением иммунной системы, длительным течением, полиморфностью клинических симптомов, абсолютной летальностью, быстрым эпидемическим распространением. ВИЧ-инфекция — типичный антропоноз.
Таксономия. ВИЧ — лимфотропный вирус, относится к семейству Retroviridae роду Lentivirus. Выделяют два типа вируса ВИЧ-1 и ВИЧ-2, которые отличаются по структурным и антигенным характеристикам.
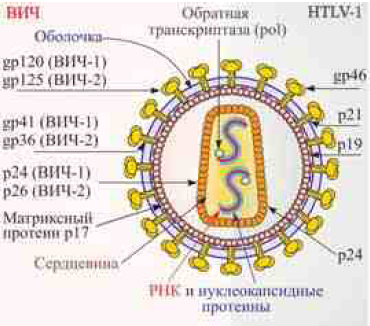 Структура. ВИЧ — сложноорганизованный вирус шарообразной формы диаметром 100–150 нм. Капсид имеет форму усеченного конуса, состоящего из 2000 копий белка р24. В капсиде хранятся две молекулы плюс- РНК, ферменты (обратная транскриптаза, интеграза и протеаза) и нуклеопро-теины (р7, р6, р9). Он окружен матриксным белком р17. Сверху находится двухслойная липопротеиновая оболочка, пронизанная гликопротеиновыми шипами (72 шипа). Каждый шип состоит из трех молекул трансмембранного гликопротеина gp41 и поверхностного гликопротеина gp120. В состав оболочки входят мембранные белки клетки, в которой репродуцировался вирус. Геном ВИЧ представлен двумя нитями РНК и состоит из трех основных структурных генов (gag, pol, env) и семи регуляторных и функциональных генов (tat, rev, nef, vif, vpr, vpu, vpx). Ген gag (от англ. group antigen — групповой антиген) кодирует матриксные, капсидные, нуклеокапсидные белки. Ген pol кодирует ревертазу, интегразу, РНКазу и протеазу. Ген env кодирует поверхностный гликопротеин gp120 и трансмембранный гликопротеин gp41. Функциональные гены выполняют регуляторные функции и обеспечивают осуществление процессов репродукции и участие вируса в инфекционном процессе.
Структура. ВИЧ — сложноорганизованный вирус шарообразной формы диаметром 100–150 нм. Капсид имеет форму усеченного конуса, состоящего из 2000 копий белка р24. В капсиде хранятся две молекулы плюс- РНК, ферменты (обратная транскриптаза, интеграза и протеаза) и нуклеопро-теины (р7, р6, р9). Он окружен матриксным белком р17. Сверху находится двухслойная липопротеиновая оболочка, пронизанная гликопротеиновыми шипами (72 шипа). Каждый шип состоит из трех молекул трансмембранного гликопротеина gp41 и поверхностного гликопротеина gp120. В состав оболочки входят мембранные белки клетки, в которой репродуцировался вирус. Геном ВИЧ представлен двумя нитями РНК и состоит из трех основных структурных генов (gag, pol, env) и семи регуляторных и функциональных генов (tat, rev, nef, vif, vpr, vpu, vpx). Ген gag (от англ. group antigen — групповой антиген) кодирует матриксные, капсидные, нуклеокапсидные белки. Ген pol кодирует ревертазу, интегразу, РНКазу и протеазу. Ген env кодирует поверхностный гликопротеин gp120 и трансмембранный гликопротеин gp41. Функциональные гены выполняют регуляторные функции и обеспечивают осуществление процессов репродукции и участие вируса в инфекционном процессе.
Антигенные свойства. Антитела вырабатываются на все белки, продукты генов env, gag, pol, но наиболее значимый иммунный ответ вызывают группоспецифический антиген р24 и поверхностные гликопротеины gp160, gp120, gp41. Помимо антигенной специфичности gp41 обеспечивает слияние вирусной оболочки с клеточной мембраной. Поверхностный gp120 содержит участок, ответственный за прикрепление вируса к клеточному рецептору CD4 и корецепторам. Он несет главную антигенную детерминанту, на которую вырабатываются антитела. Участок гена env, кодирующий gp120, обладает повышенной мутабельностью, поэтому в каждом цикле репликации образуются новые варианты gp120.
Разновидности ВИЧ. На основе последовательности в env- гене ВИЧ-1 подразделяется на три группы (М, N, O). O и N характерны для Западной Африки. М является доминирующей группой, которая подразделяется на 10 субтипов (A-К), имеющих различное географическое распространение. В России превалирует субтип А. ВИЧ-1 и ВИЧ-2 различаются по строению генома и антигенным характеристикам. В частности, геномы ВИЧ-2 и ВИЧ-1 отличаются структурой гена env
и заменой гена vpu на vpx. ВИЧ-2 вместо белков ВИЧ-1 (gp120, gp41, gp160, p24) содержит белки gp140, gp105, gp36, p26.
Культивирование. Вирус культивируется только в специальных культурах клеток.
Резистентность. ВИЧ погибает при использовании всех известных дезинфицирующих средств, под влиянием солнечных лучей, УФ-излучения, 70% этилового спирта. Нагревание до 56 С резко снижает инфекционность вируса, а при нагревании до 70 С вирус инактивируется через 10 мин. Вирус жизнеспособен в течение нескольких лет в замороженной сыворотке крови и сперме.
В высушенной плазме крови при температуре 23–27 С вирусная активность сохраняется 7 дней.
Эпидемиология. Эпидемией ВИЧ-инфекции в той или иной степени охвачены все континенты. Эпицентром эпидемии ВИЧ-1 является Восточная Африка, а ВИЧ-2 преимущественно распространен в Западной Африке. По данным ВОЗ, на конец 2007 г. в мире проживало более 40 млн человек, зараженных ВИЧ, а более 3 млн умерли от этой инфекции. Эпидемия ВИЧ в РФ продолжает развиваться. Среди ВИЧ-инфицированных в РФ 50% в возрасте 15–24 года. К кон-цу 2007 г. число зараженных превысило 400 тыс. человек. Продолжает расти число ВИЧ-инфицированных и в развитых странах (США, Западная Европа, Канада, Австралия). Отчасти это связано с широким применением антиретровирусной терапии, которая продлевает жизнь ВИЧ-инфицированным, отчасти за счет появления новых случаев инфекции. Прежде всего из-за небезопасного секса между мужчинами (44%), незащищенных гетеросексуальных отношений (34%) и внутривенного применения наркотиков (17%). Основные способы передачи ВИЧ-инфекции характерны для всех парентеральных инфекций и включают: гетеро- и гомосексуальные контакты, переливание крови и кровепродуктов, внутривенное употребление наркотиков, пересадку органов и тканей, вертикальную передачу (от матери к ребенку во время беременности, родов, кормления грудью), профессиональные заражения (укол или порез инфицированными инструментами).
Репликация. ВИЧ инфицирует клетки, несущие на своей поверхности CD4-рецептор и хемокиновые рецепторы (CCR5 и CXCR4). Этими рецепторами обладают Т-хелперы, макрофаги, фолликулярные дендритные клетки, клетки островков Лангерганса, клетки микроглии мозга.
Вначале вирус связывается с CD4-рецептором. Связывание с хемокиновыми рецепторами необходимо для слияния вириона с клеточной мембраной, обеспечивающего проникновение вируса в клетку. Взаимодействие с корецепторами приводит к конформационным изменениям в gp41, запуская слияние мембран.
Жизненный цикл ВИЧ состоит из четырех стадий:
1) адсорбция и проникновение вируса в клетку путем эндоцитоза;
2) высвобождение вирусной РНК, синтез ДНК провируса и интеграция его в геном клетки-хозяина;
3) синтез РНК вируса, трансляция и формирование вирусных белков;
4) сборка, созревание и высвобождение из клетки путем почкования вновь сформированных вирионов.
Полный жизненный цикл вируса реализуется за 1–2 суток, причем за это время формируется более одного миллиарда вирусных частиц.
Патогенез. В результате взаимодействия с ВИЧ гибнут Th-лимфоциты, клетки нейроглии мозга. В-лимфоциты подвержены неспецифической поликлональной активации. При этом снижается число CD4-лимфоцитов, а также соотношение CD4/CD8. Моноциты, макрофаги, клетки островков Лангерганса, дендритные клетки в результате взаимодействия с ВИЧ не деградируют, действуя как резервуар инфекции для заражения других клеток путем межклеточного слияния, позволяя вирусу распространяться, избегая нейтрализующего действия антител.
Дендритные клетки — первые, с кем ВИЧ встречается при половой передаче. На их поверхности помимо CCR5-корецептора и CD4 имеется лектиновый рецептор, который способен связываться с gp120. В результате этого связывания ВИЧ не проникает внутрь дендритной клетки, а остается в инфекционной форме. Таким образом, дендритные внутриэпителиальные клетки и клетки, локализованные в слизистой оболочке, присоединяют вирус при его передаче половым
путем и доставляют в инфекционной форме в лимфатический узел, передавая его Th-лимфоцитам путем межклеточного синапса, поэтому они играют важную роль в передаче вируса Т-хелперам при половых контактах. Инфицированные макрофаги служат передатчиками вируса в головной мозг, взаимодействуя с эндотелием гематоэнцефалического барьера.
Поражение иммунных клеток приводит к развитию иммунодефицитов и проявлению вторичных заболеваний инфекционной и неинфекционной природы, а также к возникновению злокачественных опухолей.
Иммунитет. Первые недели после инфицирования представляют собой период ≪серонегативного окна≫, когда антитела к ВИЧ не выявляются. Но в этот период уже через 1–2 нед. после заражения в крови методом ИФА выявляется р24, который определяется до 8-й недели после заражения, затем его содержание резко снижается. При ВИЧ-инфекции отмечается второй подъем содержания в крови белка р24. Он приходится на период формирования СПИД. Продолжительность периода ≪серонегативного окна≫ у большинства пациентов 3 мес., но может достигать и 6–10 мес.
Исчезновение в крови р24 и появление специфических антител к белкам ВИЧ знаменует наступление сероконверсии. Однажды появившись, антитела к gp120 и gp41 остаются в организме постоянно, а антитела к р24 падают.Их падение совпадает с переходом инфекционного процесса в стадию СПИДа.Но несмотря на появление антител, уровень их нейтрализующей активностинизкий в связи с появлением квазивидов вируса, вследствие чего происходитускользание ВИЧ от иммунного ответа.
Защитный иммунитет при ВИЧ-инфекции не формируется.
Клиника. Клиническая классификация ВИЧ-инфекции (по В.И. Покровскому) включает следующие стадии:
1) инкубационный период (от момента заражения до клинических проявлений острой инфекции и/или выработки антител) колеблется от 3 нед. До 3 мес.;
2) стадия первичных проявлений продолжительностью около года с момента появления симптомов острой инфекции или сероконверсии;
3) субклиническая стадия, характеризующаяся медленным развитием иммунодефицита, длительностью 6–7 лет;
4) стадия вторичных заболеваний, связанная со значительным иммунодефицитом и заканчивающаяся через 10–12 лет после начала заболевания;
5) терминальная стадия, проявляющаяся необратимым течением вторичных заболеваний (СПИД).
Основные проявления ВИЧ-инфекции и СПИДа связаны с развитием вторичных заболеваний, к которым относятся оппортунистические инфекции (пневмоцистная пневмония, токсоплазмоз, криптоспоридиоз, кандидоз, гисто-плазмоз, герпес-вирусная инфекция, гепатиты В и С, туберкулез, микобактериоз, сальмонеллез), опухоли (саркома Капоши, злокачественная лимфома), неврологические нарушения.
Микробиологическая диагностика. Первичная постановка диагноза проводится серологическим методом. При этом стандартной процедурой является обнаружение антител и р24-антигена ВИЧ методом ИФА, с последующим отдельным подтверждением наличия антител в реакции иммуноблоттинга. Диагноз ставится на основе подтверждения иммуноблоттингом наличия в сыворотке антител к двум вирусным белкам из группы env с наличием или отсутствием белков — продуктов других генов (gag и pol). В связи с изменчивостью ВИЧ при первичной постановке диагноза ПЦР не используется и по результатам ПЦР диагноз не ставится. ПЦР широко применяется после установления диагноза для оценки вирусной нагрузки в целях определения прогноза и тяжести ВИЧ-инфекции, а также для определения подтипов вируса и формирования резистентности к препаратам противовирусной терапии. Помимо специфических методов диагностики применяют иммунологические методы, позволяющие определить количество Т-лимфоцитов: CD4 и CD8. Уменьшение количества CD4 до 500 клеток/мкл говорит об иммуносупрессии.
Лечение. Основой лечения больных ВИЧ-инфекцией является антиретровирусная терапия с использованием препаратов, подавляющих репликацию вируса. Для лечения ВИЧ-инфекции используют пять групп антиретровирусных препаратов: 1) нуклеозидные ингибиторы обратной транскриптазы (азидотимидин); 2) ненуклеозидные ингибиторы обратной транскриптазы (невирапин); 3) ингибиторы протеазы (индинавир); 4) ингибиторы интегразы (ралтегравир); 5) ингибиторы слияния вирусной и клеточной мембран: блокатор хемокинового рецептора ССR5 (маривирок), блокатор gp41 (энфувиртид). Целью антиретровирусной терапии служит снижение количества вируса в организме. Полного излечения все эти препараты не дают, но часто позволяют продлить жизнь больных ВИЧ-инфекцией. К сожалению, при лечении противовирусными препаратами часто возникают устойчивые варианты вируса, что делает лечение малоэффективным. Наилучший эффект лечения достигается при использовании комбинации препаратов. Такая комбинированная терапия называется высокоактивной антиретровирусной терапией, поскольку при ее использовании у большинства пациентов уровень РНК ВИЧ снижался ниже порога определения тест-системой. Одновременно проводится лекарственная терапия, направленная на предупреждение и лечение оппортунистических инфекций.
Профилактика. Специфическая профилактика не разработана. Все попытки создать эффективную вакцину потерпели неудачу. Однако и в России и за рубежом проводятся интенсивные исследования по созданию таких препаратов. Профилактика ВИЧ-инфекции сводится к социальным и противоэпидемическим мероприятиям, а именно, к пропаганде безопасного секса с использованием презервативов, использованию одноразовых шприцев и других медицинских инструментов, контролю крови и кровепродуктов, созданию банков крови и др. Важное значение имеет своевременное выявление ВИЧ-инфицированных, борьба с проституцией, наркоманией, распущенностью, а также половое воспитание и просветительская работа среди населения. В России действует закон, предусматривающий уголовную ответственность за заведомую постановку другого лица в опасность заражения ВИЧ или умышленное заражение ВИЧ.
БЕШЕНСТВО
Бешенство (Rhabies, син.: водобоязнь, гидрофобия) — зоонозную инфекцию, развивающуюся после укуса или ослюнения раны инфицированным животным. Поражаются нейроны ЦНС с развитием симптомов возбуждения, параличом дыхательной и глотательной мускулатуры. Болезнь заканчивается летально.
Таксономия. Возбудитель бешенства — РНК-содержащий вирус, относится к семейству Rhabdoviridae роду Lyssavirus, включающему также другие вирусы (лиссавирус австралийских летучих мышей, лиссавирусы европейских лету-чих мышей 1-го и 2-го типа, Дувенхаге,
Лагос-бат, Мокола и др.), выделенные от различных животных, насекомых в Африке и сходные с вирусом бешенства.
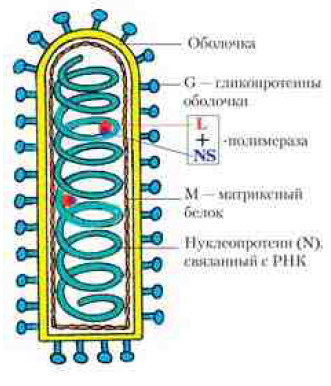 Структура и антигенные свойства. Вирион размером 75–180 нм имеет форму пули; состоит из сердцевины (рибонуклеокапсида спирального типа и матриксного белка), окруженной липопротеиновой оболочкой с гликопротеиновыми шипами. Гликопротеин G отвечает за адсорбцию и внедрение вируса в клетку, обладает антигенными и иммуногенными свойствами. Антитела к нему нейтрализуют вирус и определяются РН. Рибонуклеокапсид состоит из геном-
Структура и антигенные свойства. Вирион размером 75–180 нм имеет форму пули; состоит из сердцевины (рибонуклеокапсида спирального типа и матриксного белка), окруженной липопротеиновой оболочкой с гликопротеиновыми шипами. Гликопротеин G отвечает за адсорбцию и внедрение вируса в клетку, обладает антигенными и иммуногенными свойствами. Антитела к нему нейтрализуют вирус и определяются РН. Рибонуклеокапсид состоит из геном-
ной однонитевой линейной минус-РНК и белков: N-белка (от англ. nucleo protein), укрывающего, как чехол, геномную РНК; L- и P-белка (phosphoprotein), являющихся полимеразой вируса. Рибонуклекапсид — группоспецифический антиген, который выявляется в РСК, РИФ, РП.
Различают два идентичных по антигенам вируса бешенства:
дикий (уличный) вирус, циркулирующий среди животных, патогенный для человека;
фиксированный (virus fixe), полученный Л. Пастером в качестве антирабической вакцины многократным пассированием дикого вируса через мозг кроликов, утративший патогенность для человека, не образующий включений, не выделяющийся со слюной.
Культивирование. Вирус культивируют путем внутримозгового заражения лабораторных животных (кроликов, белых мышей, крыс, хомячков, морских свинок, овец и др.) и в культуре клеток почек хомячка, нейробластомы мыши, фибробластов человека, куриного эмбриона и др. В нейронах головного мозга зараженных животных образуются цитоплазматические включения, содержащие антигены вируса. Эти включения впервые были описаны В. Бабешем (1892) и А. Негри (1903) и названы тельцами Бабеша–Негри (эозинофильные включения вируса овальной формы размером 1–15 мкм, состоящие из вирусного рибонуклеопротеина).
Резистентность. Вирус бешенства неустойчив: быстро погибает под действием солнечных и УФ-лучей, а также при нагревании до 60 С. Он чувствителен к дезинфицирующим веществам, жирорастворителям, пропиолактону, щелочам и протеолитическим ферментам; сохраняется при низких температурах (от –20 до –70 С).
Эпидемиология. Заболевание распространено повсеместно, кроме некоторых островных государств, где осуществляются карантинные и профилактические мероприятия. Источники инфекции: в природных очагах (природное, дикое бешенство) — лисы, волки, енотовидные собаки, песцы, шакалы, грызуны, а так же насекомоядные, плотоядные и кровососущие летучие мыши; в антропургических очагах (городское бешенство) — собаки и кошки, чаще других передающие возбудителя. Вирус бешенства накапливается в слюнных железах больного животного и выделяется со слюной. Животное заразно в последние дни инкубационного периода (за 2–10 дней до клинических проявлений болезни).
Механизм передачи возбудителя — контактный при укусах, реже — при обильном ослюнении поврежденных наружных покровов. Возможен аэрогенный механизм передачи вируса, например в пещерах, населенных летучими мышами, которые многомесячно могут выделять вирус бешенства со слюной. Иногда заболевание развивается при употреблении мяса больных животных или при трансплантации инфицированных тканей (например, роговицы глаза).
У собаки после инкубационного периода (14–16 дней) появляются возбуждение, обильное слюнотечение, рвота, водобоязнь. Она грызет место укуса, посторонние предметы, бросается на людей, животных. Через 1–3 дня наступают паралич и смерть животного.
Патогенез и клиника. Вирус, попав со слюной больного животного в поврежденные наружные покровы, реплицируется и персистирует в месте внедрения. Затем возбудитель распространяется по аксонам периферических нервов, достигает клеток головного и спинного мозга, где размножается. В цитоплазме нейронов мозга, чаще в гиппокампе, обнаруживаются тельца Бабеша–Негри.
Клетки претерпевают дистрофические, воспалительные и дегенеративные изменения. Размножившийся вирус попадает из мозга по центробежным нейронам в различные ткани, в том числе в слюнные железы. Выделяется вирус со слюной за 8 суток до начала и в течение всей болезни. Инкубационный период у человека при бешенстве — от 10 дней до 3 мес., иногда до года и более, что зависит от характера и локализации повреждения. Короткий инкубационный период отмечается при множественных укусах в голову, более продолжительный — при укусах в конечности. Инкубационный период при передаче вируса летучими мышами более короткий (не более 3–4 нед.). В начале заболевания появляются недомогание, страх, беспокойство, бессонница, затем развиваются рефлекторная возбудимость, спазматические сокращения мышц глотки и гортани; дыхание шумное, судорожное. Судороги усиливаются при попытке пить, при виде льющейся воды (гидрофобия), от дуновения (аэрофобия), яркого света (фотофобия), шума (акустофобия) и при других воздействиях. Развиваются галлюцинации, а в конце болезни (на 3–7-й день) — параличи мышц конечностей и дыхания. Реже болезнь развивается без возбуждения и водобоязни; развиваются паралич и слюнотечение (тихое бешенство). Летальность — около 95%.
Иммунитет. Человек относительно устойчив к бешенству: при укусах бешеным волком заболевает около 50% не привитых людей, а бешеной собакой — около 30%. Постинфекционный иммунитет не изучен, так как больной обычно погибает. Введение людям, укушенным бешеным животным, инактивированной антирабической вакцины вызывает выработку антител, интерферонов и активацию клеточного иммунитета.
Микробиологическая диагностика. Постмортальная диагностика включает обнаружение телец Бабеша–Негри в мазках-отпечатках или срезах из ткани мозга (чаще из гиппокампа, пирамидальных клеток коры большого мозга и клеток Пуркинье мозжечка), а также выделение вируса из мозга и подчелюстных слюнных желез. Тельца Бабеша–Негри выявляют методами окраски по
Романовскому–Гимзе, Манну, Туревичу, Муромцеву и др. Вирусные антигены в клетках обнаруживают с помощью РИФ. Выделяют вирус из патологического материала путем биопробы на белых мышах: мышей-сосунков заражают интрацеребрально. Срок наблюдения до 28 дней. Обычно зараженные животные погибают через неделю. Идентификацию вирусов проводят с помощью ИФА, а также в РН на мышах, используя для нейтрализации вируса антирабический иммуноглобулин.
Прижизненная диагностика основана на исследовании отпечатков роговицы, биоптатов кожи с помощью РИФ; выделении вируса из слюны, церебро-спинальной и слезной жидкости путем интрацеребрального инфицирования мышей-сосунков. Возможно определение антител у больных с помощью РСК, ИФА.
Лечение. Симптоматическое; эффективное лечение отсутствует. Прогноз при развитии заболевания всегда неблагоприятный.
Профилактика. Профилактические мероприятия по борьбе с бешенством направлены на выявление, изоляцию или уничтожение животных — возможных источников инфекции: бродячих собак, кошек и др. Важно соблюдение правил содержания домашних животных. Проводятся карантинные мероприятия при импорте животных. Большое значение имеет иммунизация антирабической вакциной служебных и домашних собак. Животное, покусавшее людей или животных, необходимо наблюдать в течение 10 дней. Пострадавшему промывают рану водой с мылом, обрабатывают спиртом или препаратами йода. Края раны иссекают и в первые 3 дня не зашивают. Специфическую профилактику проводят антирабической вакциной и антирабической сывороткой или иммуноглобулином. В настоящее время для специфической профилактики применяют инактивированную УФ - или гамма-лучами культуральную вакцину. Разрабатывается генно-инженерная вакцина, содержащая гликопротеин G возбудителя. Иммунизации вакциной подлежат люди, связанные с риском заражения (собаколовы, ветеринары и др.). С лечебно-профилактической целью иммунизируют людей, укушенных подозрительными на бешенство животными. При этом активный иммунитет формируется уже во время инкубационного периода. При множественных укусах для ускоренной защиты создают пассивный иммунитет введением антирабического иммуноглобулина.