Дисперсные системы. Способы выражения концентрации растворов
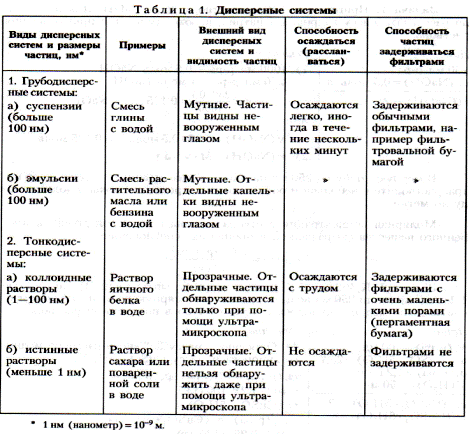
Из курса 8 класса известно, что при смешивании веществ с водой образуются однородные (гомогенные) и неоднородные (гетерогенные) системы (смеси). Примеры гомогенных систем: истинные растворы. Примеры гетерогенных систем: суспензии, эмульсии.
Дисперсная система – это смесь, состоящая из двух или более веществ, причем одно из них в виде очень маленьких частиц равномерно распределено в объеме другого. Дисперсные система состоит из дисперсной фазы и дисперсионной среды.
В зависимости от размеров частиц подразделяют дисперсные системы:
· Истинные растворы
· Коллоидные растворы (золи)
· Грубодисперсные системы (суспензии, эмульсии)
| Дисперсионная среда | Дисперсная фаза | Вид дисперсной системы | Примеры |
| Газ | Жидкость | Аэрозоли | Туман, облака |
| Твердое вещество | Дым, пыль | ||
| Жидкость | Газ | Газовые эмульсии, пены | Газированная вода, мыльная пена |
| Жидкость | Эмульсии | Молоко, жидкое сливочное масло, маргарин, крем | |
| Твердое вещество | Золи, суспензии | Краски, пасты | |
| Твердая | Газ | Твердые пены | Пемза, пенопласт, пенобетон, хлеб |
| Жидкость | Твердые эмульсии | Жемчуг, природные минералы с жидкими включениями | |
| Твердое вещество | Твердые золи | Сплавы металлов, драгоценные камни, золь золота в стекле |
Любой раствор имеет массу (mраствора), которая складывается из массы растворителя и массы растворенного вещества:
mраствора = mрастворителя + mвещества
Любой раствор имеет плотность (ρ), которая измеряется экспериментально с помощью ареометра.
Любой раствор занимает определенный объем (V), который измеряется с помощью мерного цилиндра или другой мерной посуды.
Для решения задач применяется формула:
mраствора
ρ = −---------
Vраствора
где ρ – плотность раствора, г/мл, г/см3; mраствора – масса раствора, г;
V – объем раствора, см3, мл
Массовая доля растворённого вещества - это отношение массы растворённого вещества к массе раствора.
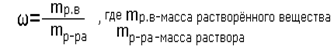
Задача1: Смешали 80 г раствора с массовой долей нитрата натрия 25 % и 20 г раствора этой же соли с массовой долей 40 %. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых.
Дано:
m1(раствора) = 80 г
ω1(NaNO3) = 25%
m2(раствора) = 20 г
ω2(NaNO3) = 40%
________________
ω3(NaNO3) -?
Решение:
Массовая доля вещества в растворе вычисляется по формуле:
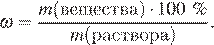
Найдем массу вещества:
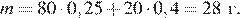
Найдем массу раствора:
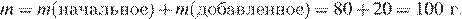
Имеем:
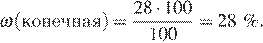
Ответ: ω3(NaNO3)=28%
Молярная концентрация раствора показывает, какое количество вещества растворено в 1л раствора. Рассчитывается по формуле:
ν
Сm= ------
V
где Сm(М) – молярная концентрация, моль/л; ν - количество вещества, моль;
V – объем раствора, л.
Выполнить самостоятельно
2. В воде растворили гидроксид калия (КОН) массой 11,2г, объем раствора довели до 200мл. Определите молярную концентрацию полученного раствора.
3. В каком объеме воды надо растворить 200г.хлорида железа (Ш) чтобы получить раствор с массовой долей растворенного вещества 15 %.?
Задачи из КИМов ЕГЭ по химии.
1. Из раствора хлорида бария массой 50 г с массовой долей соли 3% выпарили 6 г воды и добавили 1,5 г соли. Массовая доля соли в полученном растворе равна _______%. (Запишите ответ с точностью до десятых).
2. Смешали 120 г раствора сульфата натрия с массовой долей 2,5% и 10 г раствора той же соли с массовой долей 5%. Массовая доля соли в полученном растворе равна ______ %. (Запишите число с точностью до десятых).