27.06. 20
Готовимся к экзамену - отвечаем на вопросы:
1. Определение понятия «аналитическая химия». Химический состав веществ (качественный и количественный). Аналитические признаки, аналитические реакции.
2. Методы анализа. Качественный и количественный анализ веществ. Способы анализа (сухой и мокрый).
3. Стадии аналитического процесса: отбор проб, подготовка пробы, определение, обработка результатов).
4. Классификация методов анализа по массе или объему исследуемого вещества (макрометрод, полумикрометод, микрометод).
5. Способы выражения состава и концентрации растворов: массовая доля, молярная концентрация (определение, формулы для расчета).
6. Способы выражения состава и концентрации растворов: титр, молярная концентрация эквивалента (определение, формулы для расчета).
7. Строение комплексных соединений (понятия "комплексообразователь", "лиганды", "внешняя сфера", "внутренняя сфера", "координационное число"). Обяснить строение комплексных соединений на примере K2[HgI4].
8. Диссоциация воды. Ионное произведение воды. Водородный показатель.
9. Определение понятия «электролитическая диссоциация». Реакция среды различных растворов.
10. Химические реакции в водных растворах. Реакции ионного обмена. В каких случаях реакции ионного обмена идут до конца? Правила составления ионных уравнений реакций. Напишите ионные уравнения реакций: CuSO4 + 4NH4OH = [Cu(NH3)4]SO4 + 4H2O
11. "Гидролиз солей" – определение понятия. Объясните гидролиз солей на примере хлорида цинка (ZnCl2). Напишите уравнение гидролиза по первой ступени.
12. Определение понятий: "окислительно-восстановительные реакции", "окислитель", "восстановитель", "окисление", "восстановление". Приведите примеры веществ - окислителей и восстановителей. Разберите окислительно-восстановительный процесс методом электронного баланса: Mg+ N2 = Mg3N2
13. Определение понятия "окислительно-восстановительный потенциал". Охарактеризуйте электрохимический метод определения редокс-потенциала.
14. Правила работы в лаборатории качественного анализа
15. Правила работы с аналитическими весами
16. Дайте определение понятия "качественный анализ". Охарактеризуйте операции, применяемые в качественном анализе: нагревание, выпаривание, осаждение, промывание осадка, центрифугирование, фильтрование, проверка полноты осаждения.
17. Классификация катионов на аналитические группы.
18. Классификация анионов на аналитические группы.
19. Посуда и оборудование, используемые в качественном анализе
20. Правила работы в лаборатории количественного анализа.
21. Сущность и методы гравиметрического анализа
22. Посуда и оборудование, используемые в гравиметрии.
23. Сущность титриметрического анализа. Определение понятий "титриметрия", "титрование", "бюретка", "конечная точка титрования". преимущества титриметрического метода анализа.
24. Этапы титриметрического анализа. Краткая характеристика методов титриметрического анализа: кислотно-основное, окислительно-восстановительное, комплексонометрическое, осадительное титрование.
25. Посуда и оборудование, используемые в титриметрии. Правила работы с бюреткой.
26. Определение понятий "стандартные" и "вспомогательные растворы" Какой химической посудой пользуются для приготовления стандартных и вспомогательных растворов.
27. Виды стандартных растворов (первичные и вторичные). Способы приготовления стандартных растворов из твердых веществ и фиксаналов.
28. Способы выражения концентрации стандартных и вспомогательных растворов: молярная концентрация, молярная концентрация эквивалента, титр, титр по определяемому веществу (определения и формулы для расчета).
29. Общая характеристика метода кислотно-основного титрования. Два направления метода: алкалиметрия и ацидиметрия. Достоинства и недостатки метода.
30. Общая характеристика метода окислительно-восстановительного титрования. Область применения.
31. Краткая характеристика метода окислительно-восстановительного титрования перманганатометрии.
32. Краткая характеристика метода окислительно-восстановительного титрования иодометрии.
33. Краткая характеристика метода окислительно-восстановительного титрования хроматометрии. Применение хроматометрии для определения железа в рудах и сплавах.
34. Основы метода осаждения и комплексонометрии. Понятия "комплексонометрическое титрование", "комплексоны". Классификация методов. Рабочие и вспомогательные растворы в комплексонометрии. Аналитические возможности метода.
35. Физико-химические методы анализа веществ. Классификация методов (оптические, электрохимические, физико-химические методы разделения и концентрирования, радиометрические). Достоинства физико-химических методов анализа.
36. Основы фотометрического метода анализа. Краткая характеристика колориметрического, фотоколориметрического и спектрофотометрического методов анализа.
37. Краткая характеристика визуальной колориметрии и её методов: метода стандартных серий, метода колориметрического титрования, Метода уравнивания.
38. Условия и правила работы на фотоколориметре.
39. Стандартные образцы состава минерального сырья и их назначение (ГСО, ОСО, СОП).
40. Аналитический контроль в черной металлургии.
Примеры решения задач
1. При анализе 0,7205 г сплава после соответствующей обработки получена гравиметрическая форма Fe2O3 массой 0.5228г. Вычислите массовую долю (%) железа в образце.
Решение:
1)Гравиметрический фактор: F Fe /Fe2O3 = 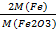 =
= 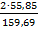 =0,6994
=0,6994
2)Массовая доля железа в образце:
w(Fe)= 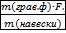 ∙ 100% =
∙ 100% = 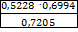 ·100%=50,75%
·100%=50,75%
Ответ: w (Fe)=50,75%
2. Рассчитайте навеску трилона Б для приготовления 250 мл раствора, если с(1/2Na2H2Y)=0,04 моль/л. (М(1/2Na2H2Y)=186,15 г/моль).
Решение:
Расчет навески:
m(Na2H2Y)=с(1/2Na2H2Y) · M(1/2Na2H2Y) · V(колбы) = 0,04·186,15 ·0,250= 1,8615 г
Ответ: m(Na2H2Y)=1,8615 г.
3. Вычислите молярную концентрацию эквивалента и титр раствора трилона Б, если на титрование 200 мл раствора MgSO4 с молярной концентрацией эквивалента 0,1 моль/л израсходовано 400 мл раствора трилона Б. (М(1/2Na2H2Y)=186,15 г/моль).
Решение:
1) Вычисляем молярную концентрацию трилона Б:
с(1/2Na2H2Y) = 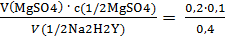 = 0,05 моль/л
= 0,05 моль/л
2) Вычисляем титр раствора трилона Б:
Т ( 1/2Na2H2Y ) = 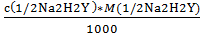 =
= 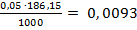 г/мл
г/мл
Ответ: Т ( 1/2Na2H2Y ) = 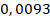 моль/л
моль/л
4. Определить титр и нормальность раствора, в 300 мл которого содержится 0,690 г K2CO3.
| Дано: g= 0,690 г V =300 мл T-? N-? | Решение: Т = g/V=0,69/300= 0,0023 Mэ (K2CO3)=1/2*(39*2+12+16*3)=69 N= T*1000/Mэ= 0,0023*1000/69=0,033 |