С появлением в процессе эволюции нервных клеток и последующим развитием примитивной нервной системы, а затем высокоорганизованного мозга у Homo sapiens формировались все более сложные формы поведения. Ответы на возбуждающие стимулы, осуществляемые у большинства видов при участии нервных клеток, являются предопределенными и видоспецифическими, например плетение паутины, брачные танцы птиц. Очевидно, что познавательные способности присущи только ограниченному числу видов. Вместе с тем можно сформулировать ряд фундаментальных вопросов, относящихся к функционированию нервных клеток всех видов. Какие химические процессы лежат в основе проведения импульса по нервному аксону, обеспечивают передачу стимулирующих или тормозящих сигналов между нервными клетками и между нервными и мышечными клетками? Если данная нервная клетка образует с другими клетками многочисленные контакты, по которым поступают как стимулирующие, так и тормозящие импульсы, то каким образом получаемая «информация» суммируется для формирования окончательного «решения»? Сумма рассмотренных выше простейших элементов активности нервной системы формирует «поведение». Представления о химических основах преобразования такой активности в наблюдаемое поведение, процесс познания и т. д. весьма фрагментарны. Пока еще очень мало данных, позволяющих понять природу процессов, интегрирующих функции нервной и эндокринной систем; значительные усилия экспериментаторов направлены на выявление возможных химических основ памяти. Хотя биохимики признают, что «разум» и «личность» — это выражение особенностей химической структуры и метаболизма мозга, понимание этих феноменов представляется делом отдаленного будущего.
|
|
Каким образом потенциальная энергия, освобождающаяся при окислении веществ, содержащихся в пище, используется для реализации множества процессов, протекающих в живой клетке с потреблением энергии?
Среди таких процессов назовем только синтез сотен новых видов молекул, накопление в клетке неорганических ионов и органических соединений (против градиентов концентрации) и осуществление механической работы. Простая аналогия между «сжигающими» пищу животными и тепловыми машинами, сжигающими топливо, оказывается неприемлемой, так как тепловая энергия не может быть использована для полезной работы при постоянной температуре. Выяснение биологического пути решения этой проблемы, заключающегося в сопряжении окисления углеводов и жиров с синтезом одного соединения, аденозинтрифосфата и в последующем использовании энергии этого соединения практически для всех эндергонических процессов, является.
Тема 2. Белки.
1. Напишите формулы аминокислот: глицина, серина, цистеина, аспарагиновой кислоты, лизина, фенилаланина и пролина.
Глицин - NH2-CH2-COOH;
Серин - HO2CCH(NH2)CH2OH;
Цистеин - HO2CCH(NH2)CH2SH;
Аспарагиновая кислота - HO2CCH(NH2)CH2CO2H;
Лизин - HO2CCH(NH2)(CH2)4NH2;
Фенилаланин –
 ;
;
Пролин –
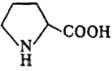 .
.
2. Рассмотрите уровни организации белковых молекул:
а) первичная структура; б) вторичная структура;
в) третичная структура; г) четвертичная структура.
а). Первичной, самой простой структурой является полипептидная цепь, т. е. нить аминокислот, связанных между собой пептидными связями. В первичной структуре все связи между аминокислотами являются ковалентными и, следовательно, прочными.
|
|
б). Следующий, более высокий уровень организации - это вторичная структура, когда белковая нить закручена в виде спирали. Между группами -СООН, находящимися на одном витке спирали, и группами -NH2 на другом витке образуются водородные связи. Они возникают на основе водорода, чаще всего находящегося между двумя отрицательными атомами. Водородные связи слабее ковалентных, но при большом их числе обеспечивают образование достаточно прочной структуры. Нить аминокислот (полипептид) далее свертывается, образуя клубок, или фибриллу или глобулу, для каждого белка специфичную. Таким образом, возникает сложная конфигурация, называемая третичной структурой.
в). Определение ее производят обычно с помощью метода рентгеноструктурного анализа, который позволяет установить положение в пространстве атомов и групп атомов в кристаллах и сложных соединениях. Связи, поддерживающие третичную структуру белка, также слабые. Они возникают, в частности, вследствие гидрофобных взаимодействий. Это силы притяжения между неполярными молекулами или между неполярными участками молекул в водной среде. Гидрофобные остатки некоторых аминокислот в водном растворе сближаются, "слипаются" и стабилизируют, таким образом, структуру белка. Кроме гидрофобных сил, в поддержании третичной структуры белка существенную роль играют электростатические связи между электроотрицательными и электроположительными радикалами аминокислотных остатков. Третичная структура поддерживается также небольшим числом ковалентных дисульфидных -S-S-связей, возникающих между атомами серы серусодержащих аминокислот. Надо сказать, что и третичная; структура белка не является конечной. К макромолекуле белка нередко оказываются присоединенными макромолекулы такого же белка или молекулы иных белков. Например, сложная молекула гемоглобина - белка, находящегося в эритроцитах, состоит из четырех макромолекул глобинов: двух альфа-цепей и двух бета-цепей, каждая из которых соединена с железосодержащим гемом. В результате их объединения образуется функционирующая молекула гемоглобина. Только в такой упаковке гемоглобин работает полноценно, т. е. способен переносить кислород.
|
|
г). Благодаря соединению нескольких молекул белков между собой образуется четвертичная структура. Если пептидные цепи уложены в виде клубка, то такие белки называются глобулярными. Если полипептидные цепи уложены в пучки нитей, они носят название фибриллярных белков. Начиная со вторичной структуры пространственное устройство (конформация) макромолекул белка, как мы выяснили, поддерживается в основном слабыми химическими связями. Под влиянием внешних факторов (изменение температуры, солевого состава среды, рН, под действием радиации и иных факторов) слабые связи, стабилизирующие макромолекулу, рвутся, и структура белка, а следовательно, и его свойства изменяются. Этот процесс называется денатурацией. Разрыв части слабых связей, изменения конформации и свойств белка происходят и под действием физиологических факторов (например, под действием гормонов). Таким образом регулируются свойства белков: ферментов, рецепторов, транспортеров. Эти изменения структуры белка обычно легко обратимы. Разрыв большого числа слабых связей ведет к денатурации белка, которая может быть необратимой (например, свертывание яичного белка при кипячении яиц). Иногда и денатурация белка имеет биологический смысл. Например, паук выделяет капельку секрета и приклеивает ее к какой-нибудь опоре. Затем, продолжая выделять секрет, он слегка натягивает ниточку, и этого слабого натяжения оказывается достаточно, чтобы белок денатурировался, из растворимой формы перешел в нерастворимую, и нить приобрела прочность.
I, II, III, IV-первичная, вторичная,
третичная, четвертичная структуры