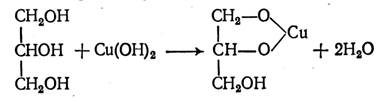Образец выполнения заданий
Задание 1: Классификации органических соединений по строению углеродного скелета и функциональным группам.
Классификацию органических молекул по строению углеродного скелета можно представить в виде схемы:

Ациклические соединения - соединения с открытой (незамкнутой) углеродной цепью. Эти соединения называются также алифатическими.
Среди ациклических соединений различают предельные (насыщенные), содержащие в скелете только одинарные связи C-C и непредельные (ненасыщенные), включающие кратные связи C = C и C 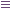 C.
C.
- предельные:

- непредельные:
Ациклические соединения подразделяют также на соединения с не разветвленной и разветвленной цепью. В этом случае учитывается число связей атома углерода с другими углеродными атомами.
Цепь, содержащая только первичные и вторичные атомы углерода, называется неразветвленной или нормальной (обозначается буквой «н-» перед названием соединения).
Цепь, в которую входят третичные или четвертичные атомы углерода, является разветвленной (в названии часто обозначается приставкой «изо»).
Например:

Циклические соединения - соединения с замкнутой углеродной цепью.
В зависимости от природы атомов, составляющих цикл, различают карбоциклические и гетероциклические соединения.
Карбоциклические соединения содержат в цикле только атомы углерода. Они делятся на две существенно различающихся по химическим свойствам группы: алифатические циклические - сокращенно алициклические и ароматические соединения.
- алицеклические:

- ароматические:

Гетероциклические соединения содержат в цикле, кроме атомов углерода, один или несколько атомов других элементов - гетероатомов (от греч. heteros - другой, иной) - кислород, азот, серу и др.

Соединения, в состав которых входят только углерод и водород, называются углеводородами.
Другие, более многочисленные, органические соединения можно рассматривать как производные углеводородов, которые образуются при введении в углеводороды функциональных групп, содержащих другие элементы.
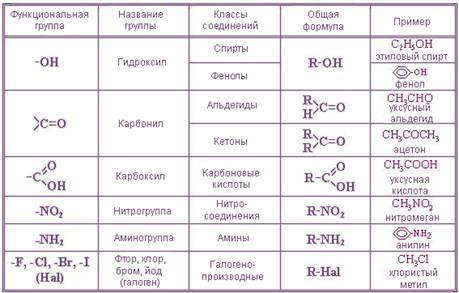
В зависимости от природы функциональных групп органические соединения делят на классы. Некоторые наиболее характерные функциональные группы и соответствующие им классы соединений приведены в таблице:
Задание 2: Анилин. Состав, строение молекулы. Получение анилина реакцией Зинина. Физические свойства анилина. Химические свойства анилина: реакции по аминогруппе и в бензольном кольце. Применение анилина.
Анилин (фениламин) – амин ароматического ряда.
C 6 H 5 – NH 2

Получение анилина в промышленности основано на реакции восстановления нитробензола, которую открыл русский учёный Н. Н. Зинин. Нитробензол восстанавливают в присутствии чугунных стружек и соляной кислоты. Вначале выделяется атомарный водород, который и взаимодействует с нитробензолом.
Fe + 2HCl → FeCl2 + 2H
C6H5 –NO2 + 6H → C6H5 –NH2 + 2H2O
Физические свойства: представляет собой бесцветную маслянистую жидкость с характерным запахом. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. Анилин более слабое основание, чем амины предельного ряда.
Строение молекулы анилина: неподеленная пара атома азота реагирует с π -системой бензольного кольца. На атоме азота появляется частично положительный заряд, и основные свойства понижаются. А в бензольном кольце, наоборот, электронная плототность повышается, и наиболее сильно в орто- и пара- положениях:

Химические свойства анилина: Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
1. Анилин энергично реагирует с бромной водой с образованием
2,4,6-триброманилина (белый осадок). Эта реакция может использоваться для качественного определения анилина:

2. Анилин взаимодействует с кислотами с образованием солей:
C6H5 –NH2 + HCl → C6H5NH3Cl (хлорид фениламмония)
2C6H5 –NH2 + H2SO4→ (C6H5NH3)2SO4 (сульфат фениламмония)
Способы применения анилина:
1) анилин – один из важнейших продуктов химической промышленности;
2) является исходным веществом для получения многочисленных анилиновых красителей;
3) используется при получении лекарственных веществ, например сульфаниламидных препаратов, взрывчатых веществ, высокомолекулярных соединений и т. д. Открытие профессором Казанского университета Н.Н. Зининым (1842 г.) доступного способа получения анилина имело большое значение для развития химии и химической промышленности.
Задание 3: Проведите качественную реакцию на глицерин.
Качественное определение глицерина: взаимодействие со свежеосажденным гидроксидом меди (II). Образуется прозрачный раствор ярко-синего цвета (глицерат меди (II)).