Химическая кинетика
Контрольные вопросы
1. Дайте определение скорости химической реакции.
2. Дайте формулировку закона действия масс для гомогенной и гетерогенной реакции.
3. Дайте определение константы скорости химической реакции. От каких параметров она зависит?
4. Охарактеризуйте влияние температуры на скорость химической реакции (правило Вант-Гоффа).
5. Прокомментируйте уравнение Аррениуса. Дайте определение энергии активации.
6. Что такое катализатор? Каков механизм действия катализатора? Приведите примеры гомогенного и гетерогенного катализа.
7. Дайте определения обратимой химической реакции и химического равновесия.
8. Дайте вывод константы химического равновесия, от каких параметров она зависит?
9. Дайте формулировку принципа Ле-Шателье.
10. Приведите пример обратимой химической реакции, объясните, как интенсивность различных параметров может влиять на смещение равновесия реакции.
Примеры решения задач
Пример 1. Как изменится скорость химической реакции: СО + О2 ® СО2, если концентрацию угарного газа повысить в 3 раза?
| Дано: | Решение: |
| [CO]2 =3[CO]1 | 1.Составим уравнение реакции: |
| Найти: n2/n1 | 2СО + О2 = 2 СО2 |
2.Напишем выражение закона действия масс для этого процесса при исходных условиях:
n1 = k[CO]2×[O2]
3.Напишем выражение закона действия масс для этого процесса с учетом повышения концентрации СО в 3 раза. (Константа скорости реакции (k) не зависит от концентрации реагентов).
n2 = k (3[CO])2×[O2]
4.Составим отношение n2/n1:
n2/n1= k (3[CO])2×[O2]/ k[CO]2×[O2]= 32/1 =9
Ответ: при возрастании концентрации СО в 3 раза скорость химической реакции увеличится в 9 раз.
Пример 2. Как изменится скорость химической реакции при снижении температуры процесса с 1030°С до 1000°С, если температурный коэффициент реакции равен 2?
| Дано: | Решение: |
| t1=1030°C | nt+10n/nt = gn |
| t2=1000°C | n = (1030-1000):10 = 3 |
| g= 2 | По условию задачи t1>t2, следовательно v1 > v2 |
| Найти: n1/n2 | n1/n2= gn, gn = 23 = 8 |
Ответ: скорость химической реакции уменьшится в 8 раз.
Пример 3. В направлении какого процесса сместится равновесие системы SO2+O2 ® SO3; DН<0 при а) возрастании концентрации SO2; б) снижении температуры; в) повышении давления; г) внесении катализатора? Составьте выражение константы химического равновесия для этой системы.
Решение:
1)Составим термохимическое уравнение:
 2 SO2 (г)+ O2(г) 2 SO3(г) + Q (ΔН<0, реакция экзотермическая)
2 SO2 (г)+ O2(г) 2 SO3(г) + Q (ΔН<0, реакция экзотермическая)
В соответствии с принципом Ле-Шателье:
а) равновесие смещается вправо, в сторону прямой реакции, понижающей концентрацию SO2;
б) равновесие смещается в сторону экзотермической реакции, т.е. вправо;
в) равновесие смещается в сторону снижения давления, т.е. вправо, т.к. меньшее число молекул газа оказывают меньшее давление;
г) равновесие не смещается, т.к. катализатор увеличивает скорость прямой и обратной реакции в одинаковое число раз.
2)Константа равновесия для реакции окисления оксида серы (IV): Kр = [SO3]2/[SO2]2×[O2]
Задачи для самостоятельного решения
Вариант 1
1. Составьте математическое выражение закона действия масс для следующего процесса: Zn(к) + H2O(пар) ® ZnO(к) + H2 (г)
2. Как изменится скорость реакции: СО (г)+ О2(г) ® СО2(г); DН<0, если а)концентрацию СО увеличить в 2 раза; б) температуру процесса повысить на 30 °С (g=2).
3. В какую сторону сместится равновесие этой химической реакции, если
а) повысить температуру;
б) увеличить давление;
в) внести катализатор;
г) увеличить концентрацию СО2?
4. Составьте выражение константы химического равновесия для процесса 2.
Вариант 2
1. Составьте математическое выражение закона действия масс для следующего процесса: СаО(тв)+ H2SO4(р-р)® CaSO4(р-р)+ H2O(ж).
2. Как изменится скорость химической реакции: SO2(г) + O2(г) ® SO3(г) , если а) концентрацию О2 увеличить в 4 раза; б) температуру процесса повысить на 40 °С (g=3)?
3. В какую сторону сместится равновесие химической реакции:
NO(г) + O2(г) ® NO2(г); DH<0, если:
а) снизить температуру;
б) увеличить давление;
в) внести катализатор;
г) увеличить концентрацию NO?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 3
1. Составьте математическое выражение закона действия масс для следующего процесса: Zn(к)+ HCl(р-р) ® ZnCl2(р-р)+ H2(г).
2. Как изменится скорость химической реакции: NO(г) + O2(г) ® NO2(г), если: а) концентрацию NO уменьшить в 3 раза; б) температуру процесса повысить на 20°С (g=3)?
3. В какую сторону сместится равновесие химической реакции:
SO2 (г)+ O2 (г) ® SO3 (г); DН<0, если:
а) снизить температуру;
б) увеличить давление;
в) внести катализатор;
г) увеличить концентрацию SO3?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 4
1. Составьте математическое выражение закона действия масс для следующего процесса: C(к) + О2 (г) ® СО(г).
2. Как изменится скорость химической реакции: O2(г) + H2(г) ® H2O(г), если: а) концентрацию Н2 уменьшить в 2 раза; б) температуру процесса повысить на 60°С (g=3)?
3. В какую сторону сместится равновесие химической реакции:
H2(г)+ O2(г) ® H2O (г); DН<0, если:
а) снизить температуру;
б) увеличить давление;
в) ввести катализатор;
г) уменьшить концентрацию Н2О?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 5
1. Составьте математическое выражение закона действия масс для следующего процесса: Mg(к) + O2(г) ® MgO (к).
2. Как изменится скорость химической реакции: SO2(г) + O2(г) ® SO3(г), если а) концентрацию SO2 увеличить в 3 раза; б) температуру процесса понизить на 40°С (g=3)?
3. В какую сторону сместится равновесие химической реакции:
H2(г) + Br2(г)® HBr(г); DH<0, если:
а) снизить температуру;
б) увеличить давление;
в) ввести катализатор;
г) уменьшить концентрацию Br2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 6
1. Составьте математическое выражение закона действия масс для следующего процесса: H2S(г) + SO2 (г) ® S(г) + H2O(ж).
2. Как изменится скорость химической реакции: N2(г) + O2(г) ®NO(г), если а) концентрацию О2 уменьшить в 4 раза; б) температуру процесса повысить на 30°С (g=2)?
3. В какую сторону сместится равновесие химической реакции:
СаСО3(к) ® СаО(к) + СО2(г); DН>0, если:
а) повысить температуру;
б) увеличить давление;
в) ввести катализатор;
г) увеличить концентрацию СО2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 7
1. Составьте математическое выражение закона действия масс для следующего процесса: Fe(к) + CuSO4(р-р) ® Cu(к) + FeSO4 (р-р).
2. Как изменится скорость химической реакции: N2 (г) + H2 (г) ® NH3(г), если а) концентрацию N2 увеличить в 2 раза; б) температуру процесса повысить на 40 °С (g=2)?
3. В какую сторону сместится равновесие химической реакции:
H2 (г) + Сl2(г) ® НСl(г); DН<0, если:
а) снизить температуру;
б) увеличить давление;
в) ввести катализатор;
г) уменьшить концентрацию Сl2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 8
1. Составьте математическое выражение закона действия масс для следующего процесса: CaO (к) + CO2(г) ® CaCO3(к).
2. Как изменится скорость химической реакции:
H2S(г) + SO2(г)® S(к) + H2O(ж), если: а) концентрацию H2S уменьшить в 3 раза; б) температуру процесса повысить на 30°С (g=2)?
3. В какую сторону сместится равновесие химической реакции:
HI(г) ® H2 (г) + I2(г); DН>0, если:
а) снизить температуру;
б) увеличить давление;
в) ввести катализатор;
г) уменьшить концентрацию HI?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 9
1. Составьте математическое выражение закона действия масс для следующего процесса: Са(к) + Н2О(ж) ® Са(ОН)2(р-р) + Н2 (г) .
2. Как изменится скорость химической реакции: CO2 (г) + C (к) ® CO(г), если а) концентрацию СО2 уменьшить в 2 раза; б) температуру процесса повысить на 40°С (g=2)?
3. В какую сторону сместится равновесие химической реакции:
NO(г) + О2(г) ® NO2(г); DН<0, если:
а) снизить температуру;
б) уменьшить давление;
в) ввести катализатор;
г) уменьшить концентрацию NO2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 10
1. Составьте математическое выражение закона действия масс для следующего процесса: FeO(к) + СO(г) ® Fe(к) + СО2(г)
2. Как изменится скорость химической реакции: H2(г) + I2(г) ® HI(г), если:
а)уменьшить концентрацию Н2 в 2 раза; б) повысить температуру процесса на 60°С (g=4)?
3. В какую сторону сместится равновесие химической реакции:
Mg(к) + CO2(г) ® MgO(к) + CO(г); DН<0, если:
а) повысить температуру;
б) увеличить давление;
в) ввести катализатор;
г) уменьшить концентрацию СО2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 11
1. Составьте математическое выражение закона действия масс для следующего процесса:
Fe2O3(к)+ CO (г) ® FeO(к) + CO2 (г).
2. Как изменится скорость химической реакции: C(к) + O2(т) ® CO2(г), если
а) концентрацию О2 увеличить в 3 раза; б) температуру процесса понизить на 20°С (g=3)?
3. В какую сторону сместится равновесие химической реакции:
CH4 (г) + O2 (г) ® CO2 (г) + H2O(г); DH<0, если
а) повысить температуру;
б) увеличить давление;
в) ввести катализатор;
г) увеличить концентрацию О2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 12
1. Составьте математическое выражение закона действия масс для следующего процесса: SO2 (г) + Li2O(к) ® Li2SO3(к).
2. Как изменится скорость химической реакции: Н2(г) + S(к) ® Н2S (г), если:
а) концентрацию Н2 уменьшить в 4 раза; б) температуру процесса повысить на 30 °С (g=2)?
3. В какую сторону сместится равновесие химической реакции:
SnO (к) + H2 (г) ® Sn(к) + H2O (г); DН>0, если:
а) повысить температуру;
б) уменьшить давление;
в) ввести катализатор;
г) уменьшить концентрацию Н2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 13
1. Составьте математическое выражение закона действия масс для следующего процесса: CaO(к) + CO2(г) ® СaCO3(к).
2. Как изменится скорость химической реакции:
H2S(г) + O2(г) ® S(к) + H2O(г), если: а) концентрацию сероводорода увеличить в 2 раза; б) температуру процесса повысить на 40°С (g = 2)?
3. В какую сторону сместится равновесие химической реакции:
С(к) + H2O(г) ® CO(г) + H2(г); DН>0, если
а) повысить температуру;
б) уменьшить давление;
в) внести катализатор;
г) уменьшить концентрацию СО?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 14
1. Составьте математическое выражение закона действия масс для следующего процесса: Н2О(ж) + Li2O(к) ® LiOH(р-р).
2. Как изменится скорость химической реакции: H2(г)+ Cl2(г) ®HCl(г), если: а)концентрацию Н2 увеличить в 2 раза; б) температуру процесса повысить на 30°С (g = 2)?
3. В какую сторону сместится равновесие химической реакции:
Н2(г) + С(графит) ® СН4(г); DН<0, если:
а) снизить температуру;
б) уменьшить давление;
в) внести катализатор;
г) уменьшить концентрацию Н2?
4. Составьте выражение константы химического равновесия для процесса 3.
Вариант 15
1. Составьте математическое выражение закона действия масс для следующего процесса: Cu(к) + HNO3(р-р)® Cu(NO3)2(р-р) + NO(г) + H2O(ж).
2. Как изменится скорость химической реакции: H2S(г)+O2(г)®SO2(г)+H2O(г), если: а) концентрацию О2 уменьшить в 3 раза; б) температуру процесса повысить на 40°С (g=3)?
3. В какую сторону сместится равновесие химической реакции:
СН4(г) + Н2О(г)® СО(г) + Н2(г); DН<0, если
а) снизить температуру;
б) уменьшить давление;
в) внести катализатор;
г) увеличить концентрацию Н2.
4. Составьте выражение константы химического равновесия для процесса 3.
Тестовые задания для самоконтроля
1. Как изменится скорость химической реакции А + 2В = АВ2, если концентрацию вещества В увеличить в 2 раза?
1) увеличится в 2 раза;
2) уменьшится в 2 раза;
3) увеличится в 4 раза.
2. Как называется реакция, которая идет на границе раздела фаз?
1) гомогенная;
2) гетерогенная;
3) экзотермическая.
3. Как изменится скорость реакции при повышении температуры на 20о, если температурный коэффициент реакции равен 3?
1) увеличится в 3 раза;
2) уменьшится в 9 раз;
3) увеличится в 9 раз.
4. В какую сторону сместится равновесие реакции: 2CO(г) + O2(г) =2CO2(г); - ∆Н, при а) повышении давления, б) понижении температуры?
1) а) →, б) →;
2) а)←, б)←;
3) а) →, б) ←.
5. Скорость реакции увеличивается в 2-4 раза при повышении температуры на каждые 10о - это:
1) закон действия масс;
2) принцип Ле-Шателье;
3) правило Вант-Гоффа.
6. Скорость реакции пропорциональна концентрации реагирующих веществ в степени их стехиометрических коэффициентов – это:
1) Закон действия масс;
2) Правило Вант-Гоффа;
3) Принцип Ле-Шателье.
7. Константа скорости химической реакции не зависит от…
1) природы реагирующих веществ;
2) концентрации реагирующих веществ;
3) температуры.
8. Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в таком направлении, которое ослабляет внешнее воздействие –
1) закон действия масс;
2) принцип Ле-Шателье;
3) правило Вант-Гоффа.
9. Состояние химического равновесия не зависит от:
1) концентрации реагирующих веществ;
2) присутствия катализатора;
3) температуры.
10. Механизм действия катализатора объясняется …
1) увеличением доли активных молекул;
2) увеличением скорости движения молекул;
3) понижением энергии активации реакции за счет образования промежуточного комплекса катализатора с реагирующим веществом.
Ключи к тестовым заданиям
| № вопроса | ||||||||||
| № ответа |
Растворы. Дисперсные системы.
Контрольные вопросы
1. Опишите растворы как гомогенные системы.
2. Дайте определения способам выражения состава растворов (массовая доля, молярная и нормальная концентрации).
3. Охарактеризуйте свойства разбавленных молекулярных растворов (понижение давления пара растворителя, повышение температуры кипения, понижение температуры замерзания, осмотическое давление).
4. Охарактеризуйте растворы электролитов, их отличия от молекулярных растворов.
5. Приведите основные положения теории электролитической диссоциации С. Аррениуса и сольватной теории Д.И. Менделеева.
6. Дайте определение степени диссоциации электролитов. Как подразделяют электролиты по степени диссоциации? Приведите примеры ступенчатой диссоциации многоосновных кислот и многокислотных оснований.
7. Охарактеризуйте диссоциацию слабых электролитов как обратимый процесс. Приведите вывод уравнения закона разбавления Оствальда.
8. Объясните, почему константа диссоциации сильных электролитов изменяется с изменением концентрации.
9. Чем определяется направленность реакций в растворах электролитов? Приведите формулировку правила Бертолле.
10. Охарактеризуйте воду как слабый электролит константой диссоциации. Что такое водородный показатель? Как он характеризует кислотность раствора?
11. Покажите, как растворимость малорастворимых веществ характеризуется произведением растворимости (ПР).
На вопросы 12-20 студенты специальности «Инженерная защита окружающей среды» не отвечают.
12. Дайте определение дисперсных систем, дисперсной фазы и дисперсионной среды. Приведите классификацию дисперсных систем по агрегатному состоянию фаз. Приведите примеры дисперсных систем.
13. Охарактеризуйте коллоидные растворы, их подразделение на лиофобные и лиофильные.
14. На примере рассмотрения границы раздела фаз жидкость – газ объясните, что такое свободная поверхностная энергия и поверхностное натяжение.
15. Опишите поверхностные явления – адсорбцию и десорбцию. Дайте определения понятиям – адсорбент, адсорбат, адсорбтив.
16. Опишите строение коллоидной частицы.
17. Объясните механизм возникновения и строение двойного электрического слоя на поверхности коллоидных частиц.
18. Опишите методы получения коллоидных растворов.
19. Объясните что такое коагуляция и седиментация коллоидных растворов, как их вызвать и как предотвратить.
20. Опишите оптические и кинетические свойства коллоидных растворов.
Примеры выполнения заданий
| Дано: СН(AlCl3)=0,3 моль-экв/л Vр-ра=200мл=0,2 л | Решение.
 ,
Найдем массу соли: mв-ва=Cн×M×f×Vр-ра,
М(AlCl3)= 27+3×35,5=133,5 (г/моль);
f(AlCl3) =1/3
m(AlCl3)=0,3×133,5×0,2×1/3=26,7 (г) ,
Найдем массу соли: mв-ва=Cн×M×f×Vр-ра,
М(AlCl3)= 27+3×35,5=133,5 (г/моль);
f(AlCl3) =1/3
m(AlCl3)=0,3×133,5×0,2×1/3=26,7 (г)
|
| Найти: m(AlCl3). |
Пример 1. Какая масса соли необходима для приготовления 200 мл
Ответ: m(AlCl3)=26,7 г.
Пример 2. Составьте выражения констант диссоциации для угольной и сернистой кислот. Пользуясь таблицей 7, определите, какая из них является более слабым электролитом. Рассчитайте степень диссоциации сернистой кислоты в 0,001 М растворе.
 H2CO3 H+ + HCO3-
H2CO3 H+ + HCO3- 
 HCO3- H+ + CO32-
HCO3- H+ + CO32- 
Kобщ = K1×K2 = 4,5×10-7×4,7×10-11=2,1×10-17
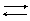 H2SO3 H+ + HSO3-
H2SO3 H+ + HSO3- 
 HSO3- H+ + SO32-
HSO3- H+ + SO32- 
Kобщ=K1×K2=1×10-9
Из сравнения значений констант диссоциации угольной и сернистой кислот видно, что угольная кислота более слабая (K(H2CO3)< K(H2SO3)).
| Дано: К(H2SO3)=1×10-9 CM=0,001моль/л=10-3моль/л | Решение:
a=  = = 
|
| Найти: a(H2SO3) | Ответ: a=10-3. |
Пример 3. Составьте выражения ПР гидроксидов магния и железа(II), пользуясь таблицей 6, сравните их растворимость.
В насыщенных водных растворах труднорастворимых веществ устанавливаются гетерогенные равновесия между осадком и ионами электролита в растворе:
 Mg(OH)2(к) Mg2+ + 2OH- ПР(Mg(OH)2) = [Mg2+][OH-]2 = 2,3×10-13
Mg(OH)2(к) Mg2+ + 2OH- ПР(Mg(OH)2) = [Mg2+][OH-]2 = 2,3×10-13
 Fe(OH)2(к) Fe2+ + 2OH- ПР(Fe(OH)2)= [Fe2+][OH-]2 =7,9×10-16
Fe(OH)2(к) Fe2+ + 2OH- ПР(Fe(OH)2)= [Fe2+][OH-]2 =7,9×10-16
ПР(Mg(OH)2)>ПР(Fe(OH)2).
Растворимость гидроксида магния больше растворимости гидроксида железа(II).
Пример 4. Произведение растворимости AgIO3 равно 3,2×10-8 при 25oC. Рассчитайте молярную концентрацию AgIO3 в его насыщенном при данной температуре растворе.
| ПР(AgIO3)=3,2×10-8 | Решение:
 AgIO3(к) Ag++IO3- AgIO3(к) Ag++IO3-
|
| Найти: СМ. | Находим молярную концентрацию AgIO3 в его насыщенном растворе над осадком: ПР=[Ag+][IO3-],
СМ(AgIO3)=[Ag+]=[IO3-]=  =1,79×10-4(моль/л) =1,79×10-4(моль/л)
|
Ответ: СМ=1,79×10-4 моль/л.
Пример5. Рассчитайте концентрацию ОН- - ионов, а также рН и рОН раствора, укажите реакцию среды, если [H+]=8,32×10-4 моль/л.
| Дано: | Решение. pH= - lg[H+] |
| [H+]=8,32×10-4моль/л | pH=-lg8,32×10-4=-(lg8,32+lg10-4)=-(0,92-4)=3,08; pH<7 |
| Найти: [OH-], pH, pOH, указать среду. | Кв=[H+][OH-]=10-14;  (моль/л) (моль/л)
|
рОН=-lg[OH-]; pOH= - lg1,2×10-11= - (lg1,2+lg10-11)= - (0,08-11)=10,92
Проверка: рН+рОН=14; 3,08+10,92=14
Ответ: [OH-]=1,2×10-11моль/л; рОН=10,92; рН=3,08; среда кислая.
Пример 6. Какие из указанных солей подвергаются гидролизу: нитрат лития, сульфат хрома (III), ортофосфат натрия, сульфид хрома (III)? Приведите ионные и молекулярные уравнения гидролиза, укажите реакцию среды и условия смещения равновесия.
Гидролизу подвергаются те растворимые соли, которые образованы слабым основанием (гидролиз по катиону) или слабой кислотой (гидролиз по аниону), т.к. лишь взаимодействие их ионов приводит к образованию слабого электролита (связыванию ионов) и смещению ионного равновесия диссоциации воды.
Алгоритм составления уравнений обратимого гидролиза:
1.Составьте краткое ионное уравнение взаимодействия одного иона слабого электролита с одной молекулой воды. Укажите рН раствора соли (> или <7), а также влияние подкисления или подщелачивания среды на смещение равновесия гидролиза (в соответствии с принципом Ле-Шателье).
2.Составьте полное ионное уравнение, приписав к левой и правой частям уравнения формулы ионов сильного электролита, не участвующих в гидролизе.
3.Составьте молекулярное уравнение гидролиза соли по первой ступени, при необходимости расставьте коэффициенты.
4.Если гидролиз идет по трехзарядному иону, составьте уравнения гидролиза по второй ступени, повторив действия 1-3 и приняв за исходную соль продукт первой ступени. Учтите, что число стадий гидролиза по многозарядному иону, реально протекающих при обычных условиях, как правило, на одну меньше, чем заряд иона, т.к. каждая последующая стадия привела бы к образованию более сильного электролита.
Решение.
LiNO3 – соль образована сильным основанием (LiOH) и сильной кислотой (HNO3), гидролизу не подвергается, т.к. ионы Li+ и NO3- не образуют с водой слабых электролитов, рН=7.
Cr2(SO4)3 – соль образована слабым основанием (Cr(OH)3), и сильной кислотой (H2SO4), гидролиз по катиону.
 I ступень Cr3+ + HOH CrOH2+ + H+ pH<7
I ступень Cr3+ + HOH CrOH2+ + H+ pH<7
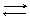 Cr3+ + SO42- + HOH [CrOH]2+ + H+ + SO42-
Cr3+ + SO42- + HOH [CrOH]2+ + H+ + SO42-
 Cr2(SO4)3 + 2HOH 2[CrOH]SO4 + H2SO4
Cr2(SO4)3 + 2HOH 2[CrOH]SO4 + H2SO4
 II ступень [CrOH]2+ + HOH [Cr(OH)2]+ + H+
II ступень [CrOH]2+ + HOH [Cr(OH)2]+ + H+
 [CrOH]2+ + SO42- + HOH [Cr(OH)2]+ + H+ + SO42-
[CrOH]2+ + SO42- + HOH [Cr(OH)2]+ + H+ + SO42-
 2[CrOH]SO4 + 2HOH [Cr(OH)2]2SO4 + H2SO4
2[CrOH]SO4 + 2HOH [Cr(OH)2]2SO4 + H2SO4
По третьей ступени гидролиз практически не идет, т.к. это привело бы к образованию более сильного электролита Cr(OH)3, чем Cr(OH)2+.
Усилить гидролиз можно связыванием протонов в воду, т.е. добавлением щелочи, а также нагреванием и разбавлением раствора. К смещению равновесия гидролиза влево приведет добавление кислоты.
Na3PO4 – соль образована сильным основанием (NaOH) и кислотой средней силы (H3PO4), гидроанионы которой являются слабыми электролитами (гидролиз по аниону).
 I ступень PO43- + HOH HPO42- + OH- pH>7
I ступень PO43- + HOH HPO42- + OH- pH>7
 PO43- + Na+ + HOH HPO42- + Na+ + OH-
PO43- + Na+ + HOH HPO42- + Na+ + OH-
 Na3PO4 + HOH Na2HPO4 + NaOH
Na3PO4 + HOH Na2HPO4 + NaOH
 II ступень HPO42- + HOH H2PO4- + OH-
II ступень HPO42- + HOH H2PO4- + OH-
 Na+ + HPO42- + HOH H2PO4- + Na+ + OH-
Na+ + HPO42- + HOH H2PO4- + Na+ + OH-
 NaHPO4 + HOH NaH2PO4 + NaOH
NaHPO4 + HOH NaH2PO4 + NaOH
Усиление гидролиза возможно при добавлении кислоты, нагревании, разбавлении. Подщелачивание среды приведет к смещению равновесия влево.
По третьей ступени гидролиз при обычных условиях практически не идет, т.к. H3PO4 более сильный электролит, чем H2PO4-.
Cr2S3 – соль образована слабым многокислотным нерастворимым основанием Cr(OH)3 и слабой многоосновной летучей кислотой – H2S. Такие соли подвергаются полному необратимому гидролизу. При этом сразу образуются конечные продукты гидролиза – осадок слабого основания и летучая кислота.
Cr2S3 + 6H2O =2Cr(OH)3¯ + 3H2S pH»7.
Задания для самостоятельного решения
Задание 1. Решите расчетную задачу.
1. Сколько г Na2CO3 содержится в 500 мл 0,25 н раствора?
2. Какая масса KCl потребуется для приготовления 250 мл 0,15 М раствора?
3. Найдите массу NaNO3, необходимую для приготовления 150 мл 2 М раствора.
4. В каком объеме 0,1 н CuSO4 содержится 8 г безводной соли?
5. В каком объеме 0,3 М раствора NaCl содержится 2 г соли?
6. Определите молярную концентрацию раствора, содержащего 11,2 г КОН в 200 мл раствора.
7. Сколько г Na2CO3 содержится в 500 мл 0,25 н раствора?
8. Определите молярную концентрацию раствора Na2SO4, содержащего 42 г соли в 300 мл раствора.
9. Вычислите молярную концентрацию Ва(ОН)2 в растворе, если в 2 л его содержится 2 г щелочи.
10. Сколько г NaBr потребуется для приготовления 700 мл 0,15 н раствора соли?
11. Какая масса KCl потребуется для приготовления 250 мл 1,15 М раствора соли?
12. Найдите массу NaOH, необходимую для приготовления 2 л 0,3 н раствора.
13. В каком объеме 2 М раствора NaCl содержится 5 г соли?
14. Какова концентрация раствора, содержащего 9 г CaCl2 в 500 мл раствора?
15.В каком объеме 0,1 н раствора CuCl2 содержится 5 г соли?
Задание 2. Составьте уравнения диссоциации соединений, формулы которых приведены ниже. В тех случаях, где это необходимо, приведите уравнения ступенчатой диссоциации. Составьте выражения констант диссоциации предложенных кислот. Какая из двух является более слабой? Рассчитайте степень диссоциации одной из кислот в 0,01 М растворе.
| № вар. | ||||||||
| Кислоты | HClO H3BO3 | HNO2 H2Se | H2S HIO | H3BO3 HBrO | HСlO2 H2CO3 | H2SO3 HClO | HBrO H2CO3 | HIO H3PO4 |
| № вар. | ||||||||
| Кислоты | H2CO3 HCN | H2SO3 HNO2 | H2S COOH | H3BO3 HNO2 | H3PO4 HСlO2 | HClO H2S | H2Se СН3СООН |
Задание 3. Составьте выражения ПР указанных веществ, сравните их растворимость. Рассчитайте концентрацию катионов и анионов в насыщенном растворе одного из этих веществ.
| № вар. | ||||||||
| Вещества | AgBr AgCl | Mg(OH)2 MgS | CaSO4 BaSO4 | AgI AgCl | FeS CuS | SrSO4 BaSO4 | CdS CuS | AgBr AgI |
| № вар. | ||||||||
| Вещества | CaCO3 CaSO4 | HgS CuS | FeS Fe(OH)2 | CuI AgI | CuCl CuI | Cu(OH)2 CuS | Zn(OH)2 ZnS |
Задание 4. Рассчитайте концентрацию ионов ОН-, а также рН раствора, укажите реакцию среды, если концентрация ионов Н+ составляет:
| № вар. | [H+], моль/л | № вар. | [H+], моль/л | № вар. | [H+], моль/л |
| 3,82×10-12 | 9,12×10-5 | 7,55×10-7 | |||
| 2,85×10-2 | 6,38×10-10 | 4,52×10-4 | |||
| 2,88×10-6 | 8,85×10-11 | 3,33×10-3 | |||
| 5,28×10-13 | 8,32×10-6 | 1,86×10-11 | |||
| 7,56×10-1 | 6,25×10-9 | 8,84×10-12 |
Задание 5. Приведите молекулярные и ионные уравнения тех реакций, которые возможны в растворе, объясните их направленность.
| № вар. | Схемы реакций | № вар. | Схемы реакций |
| Cu(OH)2 + Na2SO4® Na2SO4 + BaCl2® Fe(OH)3 + H2SO4 ® Al(OH)3 + NaOH ® Pb(NO3)2 + H2S ® | NaOH + CaCO3® CaSO4 + SrCl2® [CuOH]2SO4 + HCl® Cu(NO3)2 + H2S® CuCl2 + AgNO3® | ||
| H2CO3 + Ca(NO3)2 ® NaCl + LiNO3 ® Cr(OH)3 + KOH ® Na2CO3 + HCl ® Ca(HCO3)2 + Ca(OH)2 ® | KCl + H2SO4® [NiOH]2SO4 + HCl® Pb(NO3)2 + Cu(OH)2 ® Na2CO3 + Ca(NO3)2 ® NH4NO3 + NaOH ® | ||
| CaCO3 + LiCl® K2S + HCl ® Mg(OH)2 + Na2SO4 ® [FeOH]2SO4 + H2SO4® Pb(OH)2 + HNO3® | Pb(OH)2 + KOH® H2S + FeCl2® ZnSO4 + Cu(OH)2® NaH2PO4 + NaOH® CaCl2 + Na2CO3® | ||
| Cu(NO3)2 + BaSO4® Ba(OH)2 + H2SO4® CuSO4 + KCl® Be(OH)2 + KOH® Ba(HCO3)2 + NaOH® | HNO3 + K2SO4® Al(OH)3 + KOH ® KOH + Na2SO4 ® CaCO3 + H2O + CO2 ® BaS + CuSO4 ® | ||
| Be(OH)2+KOH® FeOHCl2+ HCl® Na2SO4+K2CO3® NaNO3+Zn(OH)2® CaCl2+H2SO4® | Na2SiO3 + HCl® Cr(OH)3 + HNO3® CuCl2 + KNO3® CrOHSO4 + H2SO4® AgNO3 + CuCl2 ® | ||
| Ba(NO3)2 + Na2SO4 ® CuOHCl + NaOH ® KNO3 + Na2CO3® Al(OH)3 + KCl ® Na2CO3 + H2SO4® | CaS + HCl ® CoCl2 + KOH ® Pb(NO3)2 + KCl ® Be(OH)2 + Ba(OH)2® NaNO3 + H2SO4® | ||
| BaCl2 + H2SO4® Na3PO4 + H2S ® NaOH + AlCl3® PbOHNO3 + HNO3 ® Na2S + KCl ® | K2SO4 + H2SO3® BaS + CuSO4 ® Al(OH)3 + NaCl® SrSO4 + CaCl2 ® Cr(OH)3 + NaOH® | ||
| Be(OH)2 + KOH ® AgNO3 + CaCl2 ® HNO3 + CaS ® KBr + Zn(OH)2® NaHSO4 + NaOH ® |
Задание 6*. Составьте молекулярные уравнения реакций, соответствующие следующим кратким ионным.
| № вар | Краткое ионное уравнение | № вар | Краткое ионное уравнение |
| H2PO4-+OH-=HPO42-+H2O Pb2++SO42-=PbSO4¯ [Cr(OH)2]++2H+=Cr3++2H2O | 3Ag++PO43-=Ag3PO4¯ HCO3-+OH-=CO32-+H2O BaCO3+2H+=Ba2++CO2+H2O | ||
| [Fe(OH)2]++2H+=Fe3++2H2O H2S+2Ag+=Ag2S¯+2H+ CO32-+2H+=CO2+H2O | HAsO42-+OH-=AsO43-+H2O [AlOH]2++H+=Al3++H2O 2H++S2-=H2S | ||
| HCO3-+H+=H2O+CO2 Ni(OH)2+2H+=Ni2++2H2O CO32-+Ca2+=CaCO3¯ | FeOH2++2OH-=Fe(OH)3¯ MgCO3+2H+=Mg2++CO2+H2O Cu2++S2-=CuS¯ | ||
| SO32-+2H+=SO2+H2O [CuOH]++H+=Cu2++H2O 3Ca2++2PO43--=Ca3(PO4)2¯ | H2S+Pb2+=PbS¯+2H+ BaSO3+2H+=Ba2++SO2+H2O [Fe(OH)2]++OH-=Fe(OH)3¯ | ||
| H2PO4-+2OH-=PO43-+2H2O Pb2++2I-=PbI2¯ CaCO3+2H+=Ca2++CO2+H2O | Pb2++2Br-=PbBr2¯ HS-+OH-=S2-+H2O BaSeO3+2H+=Ba2++SeO2+H2O | ||
| HSO3-+OH-=SO32-+H2O Ag++I-=AgI¯ Co(OH)2+2H+=Co2++2H2O | [FeOH]++OH-=Fe(OH)2¯ Sr2++SO42+=SrSO4¯ SO32-+2H+=H2O+SO2 | ||
| 3Ba2++2PO43-=Ba3(PO4)2¯ HSe-+H+=H2Se Ag++Br-=AgBr¯ | [CuOH]++H+=Cu2++H2O H2S+2Ag+=Ag2S¯+2H+ H2AsO4-+2OH=2H2O+AsO43- | ||
| Hg2++S2-=HgS¯, [Al(OH)2]++2H+=Al3++2H2O, H++OH-=H2O |
Задание 7*. Рассчитайте концентрацию ионов Н+ и ОН- в растворе, рН которого равен:
| № вар | ||||||||
| рН | 4,3 | 10,8 | 2,6 | 12,5 | 8,3 | 11,6 | 1,8 | 6,7 |
| № вар | ||||||||
| рН | 9,4 | 3,8 | 9,3 | 2,3 | 13,2 | 5,6 | 1,1 |
З адание 8*. Какие из указанных солей подвергаются гидролизу? Приведит