Классы органических соединений
| Название класса | Общая структурная формула | Функциональная группа или структурный фрагмент | Пример | ||
| формула | название | формула | название | ||
| алканы | R–CH2–CH2–R | – | - | CH4 | метан |
| алкены | 
| 
| - | CH2=CH2 | этен |
| алкины | 
| 
| - | CHºCH | этин |
| алка-диены | 
| 
| - | CH2=CHСH=CH2 | бутадиен-1,3 |
| арены | 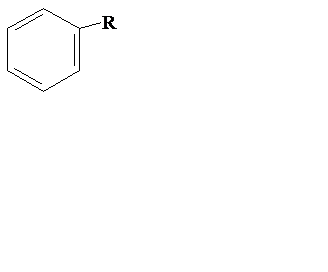
| 
| бензол | 
| метилбензол |
| галогенопроизводные УВ | R–Hal | -F,-Cl -Br, -I | фтор хлор бром иод | CH3-CH2–Br | бромэтан |
| спирты | R–OH | -OH | гидрок-сильная | CH3CH2CH2OH | пропан-1-ол |
| фенолы | Ar–OH | 
| фенол | 
| 2-бромфенол |
| простые эфиры | R-O-R | -O- | окси | CH3-O-CH3 | диметиловый эфир |
| альдегиды | 
| 
| альдегидная | 
| этаналь |
| кетоны | 
| 
| кето-группа | 
| пропанон |
| карбоновые кислоты | 
| 
| карбок-сильная | 
| этановаякислота |
 нитросоединения нитросоединения
| 
| 
| нитро- | 
| нитрометан |
| аминосоединения | R-NH2 | -NH2 | амино- | CH3-NH2 | метанамин |
Углеводороды и углеводородные радикалы
(перечислены в порядке возрастания старшинства)
| Углеводород | Радикал | Название |
| CH4 метан | CH3- | метил |
| CH3-CH3 этан | CH3-CH2- | этил |
| CH3-CH2-CH3 пропан | CH3-CH2-CH2- | пропил |

| изопропил | |
| CH3-CH2-CH2-CH3 бутан | CH3-CH2-CH2-CH2- | бутил |

| втор -бутил | |
 2-метилпропан
изобутан
2-метилпропан
изобутан
| 
| изобутил |

| трет -бутил | |
| CH2=CH2 этен | CH2=CH- | винил |
| CH3-CH=CH2 пропен | CH3-CH=CH- | пропенил |
| CH2=CH-CH2- | аллил | |
| HCºCH этин | HCºC- | этинил |
| HCºC-CH3 пропин | HCºC-CH2- | пропаргил |
 бензол
бензол
| 
| фенил |
 метилбензол
метилбензол
| 
| бензил |
Основы рациональных названий
и окончаний по систематической номенклатуре
основных классов органических соединений
| Название класса | Основа рациональных названий | Название основы | Суффикс в систематической номенклатуре |
| алканы | 
| метан | -ан |
| алкены | 
| этилен | -ен |
| алкины | 
| ацетилен | -ин |
| арены | 
| бензол | бензол |
| спирты | 
| карбинол | -ол |
| альдегиды | 
| уксусный альдегид | -аль |
| кетоны | 
| кетон | -он |
| карбоновые кислоты | 
| уксусная кислота | -овая кислота |
| амины | 
| амин | -амин |
I. Определите тип гибридизации атомов углерода для соединения
Гибридизованными атомными орбиталями образуются s-связи. Каждая одинарная связь атома углерода - это s-связь. Каждая последующая кратная - p-связь. Поэтому тип гибридизации атомов углерода можно определить по количеству s- и p-связей, которые этот атом образует с другими атомами: sp 3 - 4 s-связи (гибридизуются одна s + три p -орбитали), sp 2 - 3 s-связи (гибридизуются одна s + две p -орбитали) и 1 p-связь, sp - 2 s-связи (гибридизуются одна s + одна p -орбиталь) и 2 p-связи.
Определите, какие способы обобществления электронной пары реализуются при образовании следующих соединений и какие типы связей при этом возникают.
Коллигация (простая ковалентная связь) - каждый из атомов, участвующий в образовании связи, предоставляет по одному неспаренному электрону. При образовании такой ковалентной связи формальные заряды атомов остаются неизменными.
Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы в равной степени владеют обобществленной электронной парой. Такая связь называется неполярной ковалентной. Если связь образуется между двумя атомами с различной электроотрицательностью, то она является ковалентной полярной.
Координация (донорно-акцепторная) - оба электрона новой связи предоставляет один из атомов - донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу