Практическая работа №1
Тема: Изучение смеси рабочих газов
Цель: Сформировать умение расчетов смесей идеальных и рабочих газов
Оснащение: Методические указания для выполнения работы. Варианты заданий.
Литература:
1. В. Н. Луканин. Теплотехника. Москва,Высшая Школа, 2009 г
2. Ерофеев В. Л., Семенов П. Д., Пряхин А. С. Теплотехника. Москва, Икц «Академкнига», 2008 г.
3. В. Г. Ерохин, М. Г. Маханько. Сборник задач по основам теплотехники и гидравлики. Москва, Энергия, 1972 г.
Контрольные вопросы:
1. Напишите уравнение состояния для 1 кг идеального газа, поясните входящие величины и их размерность.
2. Напишите уравнение состояния для любого количества идеального газа, поясните величины и их размерность в системе СИ.
3. Как определить удельную газовую постоянную данного газа, если известна универсальная газовая постоянная?
4. Запишите уравнение состояния для реальных газов. Поясните физический смысл величин, входящих в эту формулу.
Порядок выполнения работы:
1. Изучаем методические рекомендации к работе.
2. Знакомимся с примерами решения заданий.
3. Выписываем необходимые для решения заданий формулы.
4. В соответствии с вариантом задания производим расчеты.
5. Делаем выводы.
Краткие теоретические сведения
Уравнения состояния идеальных газов записывают:
– для 1 кг газа
 , (1.1)
, (1.1)
– для m кг газа
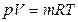 , (1.2)
, (1.2)
– для 1 моль газа
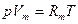 , (1.3)
, (1.3)
где 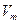 – молярный объем, м3/моль;
– молярный объем, м3/моль;  – универсальная (молярная) газовая постоянная, Дж/(моль К).
– универсальная (молярная) газовая постоянная, Дж/(моль К).
Универсальная газовая постоянная  = 8,314 Дж/(моль.К).
= 8,314 Дж/(моль.К).
Удельная газовая постоянная, Дж/(кг К),
 , (1.4)
, (1.4)
где  – молярная масса, кг/моль.
– молярная масса, кг/моль.
 , (1.4а)
, (1.4а)
где  – относительная молекулярная масса вещества.
– относительная молекулярная масса вещества.
Термодинамическая температура, К,
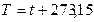 , (1.5)
, (1.5)
где 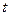 – температура в градусах Цельсия, 0С.
– температура в градусах Цельсия, 0С.
Принято приводить объем газа к так называемым нормальным условиям, при которых давление газа 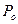 = 101,3 кПа, а температура
= 101,3 кПа, а температура  = 0 0С.
= 0 0С.
Смеси идеальных газов подчиняются законам идеальных газов. Газ (компонент) в составе смеси сохраняет свои свойства и ведет себя так, как если бы он один занимал весь объем смеси. Каждый компонент находится под своим парциальным давлением.
Давление газовой смеси
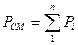 , (1.6)
, (1.6)
где 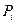 – парциальное давление компонента.
– парциальное давление компонента.
Состав газовой смеси может быть задан массовыми и объемными (молярными) долями.
Если массовая доля представляет собой отношение массы компонента к массе газовой смеси, то объемная доля – отношение парциального объема компонента к объему газовой смеси. Парциальный объем компонента приведен к температуре и давлению газовой смеси.
Для газовой смеси 
 , (1.7)
, (1.7)
где  – масса компонента;
– масса компонента;
 , (1.7а)
, (1.7а)
где 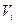 – парциальный (приведенный) объем компонента, м3.
– парциальный (приведенный) объем компонента, м3.
Плотность газовой смеси
 , (1.8)
, (1.8)
где 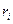 – объемная доля компонента;
– объемная доля компонента; 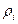 – плотность данного компонента, кг/м3;
– плотность данного компонента, кг/м3;
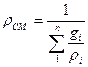 , (1.8а)
, (1.8а)
где  – массовая доля компонента.
– массовая доля компонента.
Кажущаяся молярная масса смеси идеальных газов
 , (1.9)
, (1.9)
где 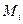 – молярная масса компонента;
– молярная масса компонента;
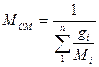 . (1.9а)
. (1.9а)
Удельную газовую постоянную рассчитывают по формуле (1.4) с использованием кажущейся молярной массы.
Соотношение между массовыми и объемными долями
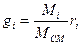 . (1.10)
. (1.10)
Парциальное давление компонента
 . (1.11)
. (1.11)
Молекулярные массы и удельные газовые постоянные некоторых газов приведены в приложении Б.
Теплоемкость определяет количество теплоты, которое необходимо подвести к телу (к системе), чтобы повысить температуру на 1 0С (на 1 К).
Теплоемкость относят к единице массы, к единице объема и к единице количества вещества. Соответственно различают удельную, объемную и молярную теплоемкости, (обозначения  ,
,  , и
, и 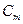 ).
).
Между указанными теплоемкостями существует функциональная связь
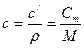 . (1.12)
. (1.12)
Объемную теплоемкость газа принято относить к объему при нормальных условиях. Поэтому при ее расчете используют плотность газа при нормальных условиях.
Теплоемкость газа зависит от характера процесса подвода (отвода) теплоты, от природы газа, его температуры и давления.
Особое значение в тепловых расчетах имеют теплоемкости газа в процессах при постоянном давлении и постоянном объеме – соответственно изобарная и изохорная теплоемкости. Их связывает между собой уравнение Майера:
– для 1 кг газа
 , (1.13)
, (1.13)
где  и
и  – изобарная и изохорная удельные теплоемкости;
– изобарная и изохорная удельные теплоемкости;
– для 1-го моля газа
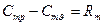 , (1.13а)
, (1.13а)
где  и
и  – изобарная и изохорная молярные теплоемкости.
– изобарная и изохорная молярные теплоемкости.
Отношение этих теплоемкостей называют показателем адиабаты
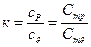 . (1.14)
. (1.14)
Для приближенных расчетов при невысоких температурах можно принимать постоянные значения молярных теплоемкостей и показателей адиабаты (приложение В). В этом случае считают теплоемкость газа постоянной.
С учетом зависимости теплоемкости от температуры различают истинные и средние теплоемкости. Истинную теплоемкость определяют при малом (бесконечно малом) изменении температуры, а среднюю – при конечном (заданном) интервале температур.
Среднюю теплоемкость в интервале температур от  до
до  принято рассчитывать как
принято рассчитывать как

 , (1.15)
, (1.15)
где 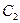 и
и  – средние теплоемкости в интервалах температур от 0 до
– средние теплоемкости в интервалах температур от 0 до  0С и от 0 до
0С и от 0 до  0С.
0С.
Значение средних изобарных теплоемкостей некоторых газов приведены в приложении Г.
Теплоемкости смеси газов:
– удельная
 , (1.16)
, (1.16)
где 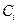 – удельная теплоемкость компонента;
– удельная теплоемкость компонента;
– объемная
 , (1.16а)
, (1.16а)
где  – объемная теплоемкость компонента;
– объемная теплоемкость компонента;
– молярная
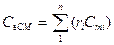 , (1.16б)
, (1.16б)
где  – молярная теплоемкость компонента.
– молярная теплоемкость компонента.
Примеры решения задач
Пример 1. В помещении 50 м3 при давлении воздуха 0,098 МПа и температуре 20 ºC произошло истечение 6 кг метана (CH4) Определить массовые и объемные доли смеси метана с воздухом.
Дано:
воздух,
1. CH4
P1 = 0,098 МПа = 98000 Па
t = 20 ºC T = 293 К
V1 = 50 м3
m2 = 6 кг
gl, g2, r1, r2 =?
Решение
а) анализ данных и формул:
Задача на расчет газовой смеси.
g = mi/ mCM, g1 + g2 = 1; mсм =?, mсм=m1+m2, m1=?
Масса воздуха в помещении из уравнения Клапейрона:
 , R=287 Дж/(кг К)
, R=287 Дж/(кг К)
µ1 = 29 кг/кмоль;
µ2 = 16кг/кмоль.
б) вычисления:
Определим массу воздуха в помещении: m1 = 98000-50/(287-293) = 58,3 кг.
Определим массу смеси метана с воздухом: mсм = 58,3 + 6 = 64,3 кг.
Определим массовые доли воздуха и метана: g1 = m1/ mсм = 58,3/64,3 = 0,908;
g2 = 1 – g1 = 1 - 0,908 = 0,092.
4) Определим объемные доли воздуха и метана:
r1= g1/ µ1 (g1/ µ1+ g2/ µ2) = 0,908/29/(0,908/29 + 0,092/16) = 0,856; г2= 1 -0,856 = 0,144.
Ответ: массовые доли. - воздуха g1 = 0,908 = 90,8 %;
- метана g2 = 0,092 = 9,2 %; объемные доли: - воздуха п = 0,856 =85,6 %;
-метана г2 = 0,144 = 14,4 %.
Пример 2. Найти абсолютное давление в котле ДКВР 6,5 x 13, если манометр показывает Ризб=1,5 МПа, а барометр Рбар=750 мм.рт.ст.
Решение
Рабс.=Ризб+Рбар=15бар+1бар=16бар
1бар=750 мм.рт.ст.
Ответ: Рабс=16бар
Пример 3. Определить удельную газовую постоянную для СО2, плотность и удельный объем при нормальных условиях.
Решение.
Определим значение удельной газовой постоянной по уравнению
Rco2= R0/  =8314.3/44=189 Дж/кг·К
=8314.3/44=189 Дж/кг·К
R0=8314.3(Дж/моль·К),
где  =44 кг/ моль - молекулярная масса СО2.
=44 кг/ моль - молекулярная масса СО2.
Определим удельный объем и плотность углекислого газа при нормальных условиях(Ро=101325 Па; to = 0oC)
vo= vo /  =22.4./44=0,51 м3 /кг, но РоVo=1, откуда Ро=1/Vo=1/0,51 м3/кг=1,96 кг/м3.
=22.4./44=0,51 м3 /кг, но РоVo=1, откуда Ро=1/Vo=1/0,51 м3/кг=1,96 кг/м3.
Ответ:Rco2=189 Дж/кгК, Vo =0.51 м3/кг, Ро=1,96 кг/м3.
Задания
1. Смесь содержит а массовых долей водорода и b кислорода. Определить объемный состав смеси.
| Вариант | |||||||||||||||
| a | |||||||||||||||
| b= 100-a |
2. Определить парциальные давления кислорода и азота в смеси при нормальных
физических условиях, если массовый состав смеси:
g (О2) = a % и g(N2) =(100- a)%
| Вариант | |||||||||||||||
| a |
3. Газ состоит из a массовых долей водорода и b=100-a массовых долей кислорода. Определить объемный состав смеси, газовую постоянную и плотность при давлении p и температуре t.
| Вариант | |||||||||||||||
| a | |||||||||||||||
| p, бар | |||||||||||||||
| t, °С |