Аммиакаты Co(III).
Гексааммиакаты.
[Co(NH3)6]Cl3 желтые кристаллы, ДМ, октаэдр, Куст.=1036, устойчивы в конц. H2SO4
Пентааммиакаты.
[Co(NH3)5X]2+ , (X= Г-, NO3-, NO2- и др.) малиново-красного цвета
При X=NO2- существуют 2 изомера:
[Co(NH3)5(-NO2)]2+ нитро => Солевая изомерия
[Co(NH3)5(-ONO)]2+ нитрито => Солевая изомерия
[Co(NH3)5(H2O)]3+(Cl3) кирпично-красные кристаллы
[Co(NH3)5SO4]Br красного цвета => Ионизационная изомерия
[Co(NH3)5Br]SO4 красно-фиолетового цвета => Ионизационная изомерия
Тетрааммиакаты.
[Co(NH3)4(H2O)Cl2]Cl, 2 изомера: цис- и транс-.
[Co(NH3)4(H2O)Cl]Cl2 и [Co(NH3)4Cl2]Cl*H2O =>Ионизационная и гидратная изомерия
[Co(NH3)4(H2O)2]Cl3 и [Co(NH3)4Cl2]Cl*2H2O => Ионизационная и гидратная изомерия
Триаммиакаты.
[Co(NH3)3X3], X=Г-, NO3-, NO2-
[Co(NH3)3X3]3+ , X=H2O
Число соединений значительно больше, если учесть изомерные формы.
Например, известен комплексfac-[Co(NH3)4(NO2)3] желто-коричневого цвета (соединение - мономер (октаэдр), NH3 расположены по грани - это граневый (лицевой - от англ. Facial) и его изомер - mer-[Co(NH3)4(NO2)3] (реберный, mer - меридиональный, от meridional, - NH3 расположены по ребру).
Известны также координационные изомеры:
[Co(NH3)6]3+[Co(NO2)6]3-, [Co(NH3)4(NO2)2]+ [Co(NH3)2NO2)4]- -димерыжелтогоцвета.
Для кобальта (особенно для Co(III) известны различные аммиакосодержащие комплексные соединения. Получены гекса-, пента-, тетра-, три- и диамины Co(III). При этом преобладает октаэдрическая координация, и октаэдрические комплексы Co(III) значительно Co(II).
[Co(NH3)6]2+ [Co(NH3)6]3+
Кн7,75*10-6 3,1*10-33
рКн 5,11 32,51
Это обусловлено образованием низкоспиновых внутриорбитальных комплексов Co(III).
Комплексообразование сильно влияет на окислительно-восстановительные свойства Co(III). Так, для аквакомплексов φ0[Co(H2O)6]3+[Co(H2O)6]2+ = 1,8В, а для аммиакатов φ0[Co(NH3)6]3+[Co(NH3)6]2+ =0,1В, поэтому аммиакат Со(II) легко окисляется.
В связи с этим, гексааммиакаты Co(III) получают при окислении кислородом воздуха гексааммиаката Со(II) [Co(NH3)6]2+, барбатируя воздух через раствор в течение нескольких часов в присутствии NH4Cl и катализатора - активированного угля.
4CoCl2 + 20NH3 + 4NH4Cl +O2---активированный уголь-à ([Co(NH3)6]2+ + O2à4[Co(NH3)6Cl3 + 2H2O
Если не вводить активированный уголь, то образуется пентааммиакат [Co(NH3)5Cl]Cl2 рубиново-красного цвета.
Аммонолиз аммиакатов Co(III).
В жидком аммиаке возможен аммонолиз аммиакатов Co(III) с образованием комплексов с амидными группами NH2-
Аминаты.
Для Co(III) очень характерны разнообразные комплексы с аминами: с этилендиамином, гидроксиламином, пиридином, этиламином и многими другими аминами.[2]
Многоядерные комплексы
Если в комплексном ионе или нейтральном комплексе содержатся два и более комплексообразователей, то этот комплекс называется многоядерным. Среди многоядерных комплексов выделяют мостиковые, кластерные и многоядерные комплексы смешанного типа.
Атомы комплексообразователя могут быть связаны между собой с помощью мостиковых лигандов, функции которых выполняют ионы OH, Cl, NH2, O22, SO42и некоторые другие.
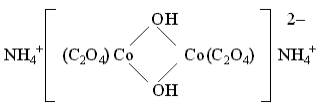
Так, в комплексном соединении (NH4)2[Co2(C2O4)2(OH)2] мостиковыми служат бидентатные гидроксидные лиганды:
В роли мостикового лиганда может выступать полидентатный лиганд, имеющий несколько донорных атомов (например, NCS с атомами N и S, способными участвовать в образовании связей по донорно-акцепторному механизму), либо лиганд с несколькими электронными парами при одном и том же атоме (например, Cl или OH
В том случае, когда атомы комплексообразователя связаны между собой непосредственно, многоядерный комплекс относят к кластерному типу. Так, кластером является комплексный анион [Re2Cl8]2

в котором реализуется четверная связь Re - Re: одна σ-связь, две π- связи и одна δ-связь. Особенно большое число кластерных комплексов насчитывается среди производных d -элементов. Многоядерные комплексы смешанного типа содержат как связь комплексообразователь-комплексообразователь, так и мостиковые лиганды.
Примером комплекса смешанного типа может служить карбонильный комплекс кобальта состава [Co2(CO)8], имеющий следующее строение:

Здесь имеется одинарная связь Co - Co и два бидентатных карбонильных лиганда CO, осуществляющих мостиковое соединение атомов-комплексообразователей. [3]
свойство кобальт синтез соль
Экспериментальная часть
Исходные вещества
(NH4)2CO3(крист., х/ч)
NH3*H2O (ώ=10%)
Co(NO3)2,
C2H5OH(ώ=96%)O2(ώ=3%)
Методика синтеза.
1 способ
Растворить 20 г безводного карбоната кобальта CoCO3 в HNO3. Для этого кислоту небольшими порциями, помешивая стеклянной палочкой, приливают к карбонату до прекращения выделения CO2 (раствор 1).Вместо карбоната кобальта можно брать в качестве исходного вещества соответствующее количество нитрата, эквивалентное 20 г карбоната.
г (NH3)2CO3 и 250 г концентрированного водного раствора аммиака добавляют в 500 мл воды (раствор 2)
Растворы 1 и 2 сливают и пропускают ток воздуха в течение часа.
10Co(NO3)2+ 26(NH4)2CO3 + 10NH3(водн.)=10[Co(NH3)4CO3]NO3+ 8NH4NO3 + 3H2O2
Выход - 20 г.. Из маточного раствора можно выделить дополнительное количество продукта. Для этого раствор кипятят в фарфоровой чашке, добавляяпостепенно 2 г (NH4)2CO3 а затем охлаждают. Выделившийся в осадок продукт содержит некоторое количество нитропентамминксбальтинитрата.
Выделившиеся кристаллы отфильтровать на воронке Бюхнера, промыть ледяной водой, затем 96% C2H5OH. Высушить соль на воздухе.
2 способ
Приготавливается аналогично, только для окисления кобальта вместо кислорода воздуха используется H2O2.
2Co(NO3)2 + 10NH3(водн.) + 2(NH3)2CO3 + 9H2O2 =2[Co(NH3)4CO3]NO3 + 4NH4NO3 + 12H2O

Кристаллы, полученные с использованием H2O2 для окисления кобальта
Синтез
Для синтеза заданной соли потребовалось приготовить 2 раствора:раствор.4 г (NH4)2CO3 в 20 млH2O, прилили 10 мл 10% NH3 и перенесли в колбу Вюрца емкостью 100 мл.раствор. 6 г Co(NO3)2 в 12 мл H2O прилили к I раствору. Закрыли колбу Вюрца пробкой, снабженной трубкой, доходящей до дна, продували воздух в течение часа.
Слили раствор в чашку, профильтровали его, упаривалина водяной бане, добавляя постепенно 2 г (NH4)2CO3до начала кристаллизации. Выделившиеся кристаллы отфильтровали на воронке Бюхнера, промыли ледяной водой, затем 96% C2H5OH. Высушили соль на воздухе.[4]

1 - шликер, 2 - пластичная масса, 3 - фильтровальная бумага, 4 - пористая пластина
10Co(NO3)2+ 26(NH4)2CO3 + 10NH3(водн.)= 10[Co(NH3)4CO3]NO3+ 8NH4NO3 + 3H2O2

Комплекс, полученный с использованием воронки Бюхнера для окисления кобальта
Выход-около 5г.
Анализ
В анализе будет доказан состав полученного соединения при помощи качественных реакций.
1. Качественная реакция на диоксид углерода.
Добавляем к синтезированной соли HCl, затем HNO3. Комплекс разрушается, образуется угольная кислота H2CO3, которая моментально распадается на H2Oи CO2. Выделение углекислого газа CO2 можно наблюдать благодаря пузырькам на поверхности. Качественныйсоставдоказан.
[Co(NH3)4CO3]NO3 + 4HCl + 2HNO3= H2O + CO2↑+ Co(NO3)3 +4NH4Cl
. Качественная реакция на аммиак
Реактив Несcлера.
Добавили к разрушенному комплексу щелочь KOH и затем реактив НесслераK2[HgI4]. Образуется красно-коричневый осадок йодида. Наличие NH3 в соединении доказано.
[Co(NH3)4CO3]NO3 + 4HCl + 2HNO3 = H2O + CO2↑+ Co(NO3)3 +4NH4Cl+ K2[HgI4] + KOH = [OHgNH2]I↓ + 2KI + HI
3. Качественная реакция на нитрат-ион.
Дифениламин
Дифениламин (C6H5)2NH с нитрат - ионом NO3- образует интенсивно-синее окрашивание, вследствие окисления дифениламина.Присутствие ионаNO3- доказано.
. Качественная реакцияна карбонат-ион
ПридобавленииNaOHвыпадает черный осадок Co(OH)3, что доказывает наличие Co3+
Co(NO3)3 + 3NaOH = Co(OH)3↓ + 3NaNO3
Вывод
Были описаны свойства кобальта и его соединений и их практическое применение. В данной работе был проведен синтез одной из солей кобальта [Co(NH3)4CO3]NO3. Было изложено 2 способа получения этой соли. С помощью качественных реакций был доказан качественный состав данного соединения.
Литература
1.Ф.Перельман «Кобальт, Краткая химическая энциклопедия, т. 2», Москва, 1963,620 с.
. Б.В. Некрасов «Основы общей химии», Изд. "Химия", 1973, 656 с.
3. А.К. Молодкин, Н.Я. Есина, Н.У. Венсковский «Химия переходных элементов», РУДН, 2007, 368с.
.Р.А. Лидин,Л.Л. Андреева, В.А. Молочко «Справочник по неорганической химии. Константы неорганических веществ. Справочное пособие»Москва, Изд.: Химия, 1987, 320 с.
. Н. Г. Ключников «Руководство по неорганическому синтезу»Москва, Изд.: "Химия", 1965, 391с.