Практическое занятие № 11
Техника титрования. Определение точной нормальной концентрации рабочего раствора.
КИСЛОТНО-ОСНОВНОЙ МЕТОД ТИТРОВАНИЯ
Метод нейтрализации.
В основе кислотно-основного метода лежит реакция нейтрализации:
Н+ + ОН¯ ↔ Н2О.
Этот метод применяется для количественного определения кислот и щелочей.
При количественном определении кислот – алкалиметрия – рабочим раствором является раствор щелочи (NаОН, КОН). Исходным веществом для установки титра рабочего раствора щелочи служит щавелевая кислота (Н2С2О4·2Н2О) или янтарная кислота (Н2С4Н4О4).
При количественном определении щелочи – ацидиметрия – рабочим раствором является раствор сильной кислоты (НС1, Н2SО4). Вещество для установки титра рабочего раствора кислоты служит бура Nа2В4О7·10Н2О или сода Nа2СО3, в некоторых случаях рабочий раствор готовят из фиксанала.
Способы метода нейтрализации.
1. Нейтрализация сильной кислоты сильным основанием.
2. Нейтрализация слабой кислоты сильным основанием.
3. Нейтрализация слабого основания сильной кислотой.
При титровании раствора любой кислоты раствором щелочи (основание), происходит связывание ионов Н+ кислоты ионами ОН¯ щелочи и концентрация ионов Н+ постепенно уменьшается, а рН раствора возрастает. При определенном значении рН достигается точка эквивалетности и титрование заканчивается.
При титровании раствора щелочи раствором кислоты связываются ионы ОН¯ и концентрация их в растворе уменьшается, а концентрация ионов Н+ увеличивается и рН раствора уменьшается.
Расчеты в объемном анализе.
Если концентрация раствора выражается нормальностью, то для расчетов при титровании пользуются формулой:

где V1, V2 — объемы растворов, мл; N1, N2 — нормальность растворов.
Нормальную концентрацию подсчитывают с точностью до четвертого десятичного знака.
При выражении точной нормальной концентрации рабочего раствора часто применяют так называемый поправочный коэффициент К. Это величина, на которую нужно умножить значение предполагаемой нормальности раствора, чтобы получить точную его концентрацию. Например, имеется приблизительно 0,1 н раствор, для которого К= 0,945. Следовательно, точное значение нормальности раствора равно 0,1 · 0,945 = 0,0945. Величину К находят, разделив определенную титриметрическинормальность раствора на предполагаемое значение нормальности раствора:

где N — экспериментально определенная точная нормальность раствора; N 0— предполагаемая нормальность раствора.
Если рабочий раствор приготовлен точно заданной концентрации из фиксанала или по точно взятой навеске, К = 1.
Концентрация раствора может быть выражена титром, т. е. в граммах вещества на 1 мл раствора:
 ,
,
где Э — эквивалентная масса вещества; N — нормальность раствора; g — навеска вещества.
В аналитических лабораториях чаще концентрацию рабочего раствора выражают через титр по определяемому веществу, т. е. массой определяемого вещества, которому соответствует 1 мл рабочего раствора. Для расчета пользуются формулой:

где х — рабочий раствор; у — определяемое вещество; NХ — нормальность рабочего раствора; ЭУ — эквивалентная масса определяемого вещества.
Титр рассчитывают до шестой значащей цифры.
Пользуясь титром раствора по определяемому веществу, легко вычислить массу определяемого вещества по формуле:

где РУ — масса определяемого вещества, г; VХ — объем рабочего раствора, пошедшего на титрование, мл; ТХ/У — титр рабочего раствора по определяемому веществу, г/мл.
Для приготовления растворов определенной концентрации навеску g рассчитывают по формуле:
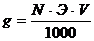
где N – заданная нормальная концентрация; Э – эквивалентная масса вещества; V – объем приготовленного раствора.
Если титровать раствор любой кислоты раствором щелочи, происходит связывание ионов Н+ кислоты ионами ОН¯ и концентрация ионов Н+ постепенно уменьшается, а рН раствора возрастает.
При определенном значении рН достигается точка эквивалентности и титрование должно быть закончено. При титровании раствора щелочи раствором кислоты связываются ионы ОН¯, и концентрация их в растворе уменьшается, а концентрация ионов Н+ увеличивается и рН раствора уменьшается. Однако значение рН в точке эквивалентности не во всех случаях имеет одно и то же значение, оно зависит от природы реагирующей кислоты и основания.
При нейтрализации сильной кислоты сильным основанием:
НС1 + NаОН = NаС1 + Н2О
образуется только один слабый электролит — вода. Реакция практически доходит до конца. Образующаяся при реакции соль гидролизу не подвергается и имеет нейтральную реакцию (рН 7,0). Следовательно, при титровании сильной кислоты щелочью и наоборот в точке эквивалентности среда раствора нейтральна, рН раствора равен 7,0.
Если вместо сильной кислоты титровать щелочью слабую кислоту, например уксусную, то происходит реакция
СН3СООН + NаОН ↔ СН3СООNа + Н2О
В растворе в точке эквивалентности будет присутствовать соль СНзСООNа, подвергающаяся гидролизу:
СН3СООNа + Н2О ↔ СН3СООН + NаОН
Следовательно, протекающая в данном случае при титровании реакция обратима и не будет доходить до конца. В точке эквивалентности в растворе будут присутствовать СН3СООН иNaOH. Слабая уксусная кислота находится в растворе в основном в виде недиссоциированных молекул, aNaOHдиссоциирован почти полностью. Концентрация ионов ОН¯ превышает концентрацию ионов Н+ и титрование будет заканчиваться при рН > 7,0.
При титровании слабых оснований сильными кислотами, например:
NН4ОН + НС ↔ NН4С1 + Н2О
образующаяся соль подвергается гидролизу. Реакция нейтрализации будет обратима и в точке эквивалентности концентрация ионов Н+ превысит концентрацию ионов ОН¯. Титрование будет заканчиваться при рН < 7,0.
Таким образом, при методе нейтрализации точка эквивалентности совпадает сточкой нейтрализации лишь при взаимодействии сильной кислоты с сильным основанием. При титровании необходимо установить точку эквивалентности, а не нейтральности и, следовательно, титрование в разных случаях приходится заканчивать при различных рН. Если вещество не растворяется в воде или разлагается водой, т. е. не может быть оттитровано в водном растворе, кислотно-основное титрование может применяться также в неводных растворах.