Методическая разработка
для проведения лекционного занятия по учебной дисциплине
«Теория горения и взрыва»
(для курсантов и студентов обучающихся по направлению подготовки 280700.62 «Техносферная безопасность» профиль «Безопасность технологических процессов и производств» квалификация (степень) «Бакалавр»)
Тема занятия 2.1 Самовоспламенение
Обсуждено на заседании ПМК "Процессов горения"
«4» июля 2012 г. протокол №11
I. Цели занятия.
Дидактическая. Дать основные понятия теории возникновения горения.
Учебная. Ознакомить слушателей (курсантов) с явлениями и механизмами самовоспламенения и самовозгорания.
Воспитательная. Формирование у обучаемых знаний, умений и навыков, позволяющих проводить различные инженерные расчеты в области пожарной безопасности.
II. Расчет учебного времени
| Содержание и порядок проведения занятия | Время, мин |
| ВСТУПИТЕЛЬНАЯ ЧАСТЬ | |
| Учебные вопросы | |
| 1. Радикально-цепной механизм процессов окисления и его основные закономерности | |
| 2. Элементы тепловой теории самовоспламенения горючих смесей | |
| 3. Механизм процессов теплового самовоспламенения веществ. | |
| ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ |
III. Литература
1. ГОСТ 12.1.004-91* Пожарная безопасность. Общие требоания.
2. ГОСТ 12.1.044-89* Пожаровзрывобезопасность веществ и материалов. Номенклатура показателей и методы их определения.
3. Теоретические основы процессов горения /Кутуев Р.Х., Малинин В.Р.,
Кожевникова Н.Ю. и др.: Учебник. - СПб.: СПбВПТШ МВД РФ, 1996.
-236с.
4. Решетов А.П., Ловчиков В.А. Теоретические основы процессов горения: Учебно-методическое пособие по решению задач. - СПб: СПбИПБ МВД
России, 1997. - 123 с.
5. Пожаровзрывоопасность веществ и материалов и средства их тушения
(Справочное издание в двух книгах) / Баратов А.Н., Корольченко А.Я.,
Кравчук Г.Н. и др. - М.: Химия.1990.
6. Демидов П.Г., Саушев B.C. Горение и свойства горючих веществ: Учебное пособие. М.: ВИПТШ МВД СССР, 1984.
7. Абдурагимов И.М. и др. Физико-химические основы развития и тушения пожаров (Учебное пособие) М.: ВИПТШ МВД СССР, 1980.
IV. Учебно-материальное обеспечение
Наглядные пособия (схемы):
1. Мультимедийный проектор;
2. Компьютерные презентации.
Содержание лекции
Введение. 6
1. Радикально-цепной механизм процессов окисления и его основные закономерности 7
2. Элементы тепловой теории самовоспламенения горючих смесей. 15
3. Механизм процесса теплового самовоспламенения веществ. 19
Заключение. Ошибка! Закладка не определена.
Введение
Горение может возникнуть в большом объеме газо- или паро-воздушной смеси, например, в результате ее воспламенения при нагревании в химическом реакторе, технологическом аппарате и т.п. В этом случае процесс горения возникает как бы самопроизвольно, поэтому его называют самовоспламенением.
Самовоспламенение - это явление резкого увеличения скорости экзотермических объемных реакций окисления, приводящее к возникновению горения и /или взрыва.
В некоторых случаях горение может возникнуть за счет самонагревания, которое обусловлено происходящими в веществах физическими, химическими и биологическими процессами при низких (до 70 °С) температурах (окисление, разложение, адсорбция, конденсация, жизнедеятельность микроорганизмов и т.д.). Этот процесс называется самовозгоранием.
Радикально-цепной механизм процессов окисления и его основные закономерности
Процессы самовоспламенения могут протекать по цепному и по тепловому механизму. Теория этих процессов разработана академиком Н.Н. Семеновым и его школой.
Рассмотрим механизм радикально-цепных реакций на примере горения водорода и углеводородов.
Основа теории цепных реакций – предположение о том, что исходные вещества превращаются в конечный продукт не сразу, а с образованием активных промежуточных продуктов
Продукт первичной химической реакции обладает большим запасом энергии, которая может рассеиваться в окружающем пространстве при соударении молекул продуктов реакции или за счет излучения, а может передаваться молекулам реагирующих компонентов, переводя их в активное состояние. Эти активные молекулы (атомы, радикалы) реагирующих веществ порождают цепь реакций, где энергия передается от одной молекулы к другой. Поэтому такие реакции называются цепными.
| Рис. 1.3. Схема протекания неразветвленной (а) и разветвленной (б) цепных реакций. |
| (а) |
| (б) |
Химически активные молекулы, атомы, радикалы, образующиеся на элементарных стадиях цепной реакции – звеньях цепи- называются активными центрами. Большую часть активных центров составляют атомы и радикалы, которые наиболее реакционно способны. Но вследствие этого они и неустойчивы, т.к. могут вступать в реакции рекомбинации с образованием малоактивных продуктов.
Длина цепи, образуемая одним начальным активным центром, может достигать несколько сотен тысяч звеньев. Кинетические закономерности цепных реакций существенно зависят от того, сколько активных центров образуется в одном звене цепи. Если при участии исходного активного центра в результате образуется только один активный центр, то такая цепная реакция называется неразветвленной, если же в одном звене цепи образуются два или более активных центров, то такая цепная реакция называется разветвленной. Скорость разветвленных цепных реакций возрастает лавинообразно, в чем и состоит причина самоускорения химических реакций окисления при горении, так как для большинства из них характерен механизм разветвленных цепных реакций.
Практически любая реакция горения может иметь одновременно признаки и теплового и цепного механизма протекания реакции. Зарождение первых активных центров может иметь тепловой характер, а реагирование активных частиц по цепному механизму приводит к выделению тепла, разогреву горючей смеси и тепловому зарождению новых активных центров.
Любая цепная реакция складывается из элементарных стадий зарождения, продолжения и обрыва цепи.
Зарождение цепи является эндотермической реакцией. Образование свободных радикалов (т.е. атомов или групп атомов, имеющих свободные валентности, например, 
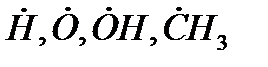 ) из молекул исходных веществ возможно в результате мономолекулярного или бимолекулярного взаимодействия, а также в результате каких-либо посторонних воздействий на горючую смесь – инициирования.
) из молекул исходных веществ возможно в результате мономолекулярного или бимолекулярного взаимодействия, а также в результате каких-либо посторонних воздействий на горючую смесь – инициирования.
Инициирование может осуществляться путем добавки специальных вещест – инициаторов, легко образующих свободные радикалы (например, пероксидов, химически активных газов 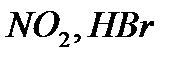 ), под действием ионизирующих излучений, под действием света – фотохимическое инициирование. Например, взаимодействие водорода с хлором
), под действием ионизирующих излучений, под действием света – фотохимическое инициирование. Например, взаимодействие водорода с хлором
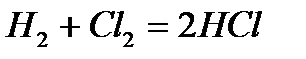
при обычных условиях протекает крайне медленно, а при сильном освещении (солнечным светом, горящим магнием) протекает со взрывом.
К реакциям продолжения цепи относятся элементарные стадии цепной реакции, идущие с сохранением свободной валентности и приводящие к расходованию исходных веществ и образованию продуктов реакции.
Примером разветвленной цепной реакции может служить реакция горения водорода в кислороде.
зарождение цепи:
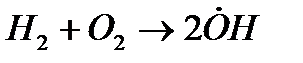
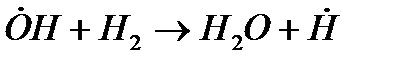
разветвление цепи:


обрыв цепи:
гомогенный

гетерогенный
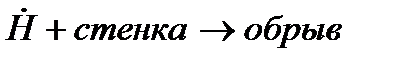

При развитии цепи, когда концентрация активных центров станет достаточно большой возможно образование такого звена, в котором активный центр прореагирует без генерации нового активного центра. Такое явление называется обрывом цепи.
Обрыв цепи может быть гомогенным и гетерогенным.
Гомогенный обрыв цепей возможен либо при взаимодействии радикалов или атомов между собой с образованием устойчивых продуктов, либо при реакции активного центра с посторонней для основного процесса молекулой без генерации новых активных центров.
Гетерогенный обрыв цепи происходит на стенках сосуда, где протекает реакция горения или поверхности твердых микрочастиц, присутствующих в газовой фазе, иногда специально вводимых (например, как при тушении порошками). Механизм гетерогенного обрыва цепей связан с адсорбцией активных центров на поверхности твердых частиц или материалов. Скорость гетерогенного обрыва цепей сильно зависит от соотношения площади поверхности стенок к объему сосуда, где происходит горение. Таким образом, уменьшение диаметра сосуда заметно снижает скорость реакции горения, вплоть до его полного прекращения. На этом основано создание огнепреградителей.
Примером разветвленной цепной реакции может служить реакция горения водорода в кислороде.
Заполним сосуд стехиометрической смесью Н2:02 = 1:1 по объему и будем медленно нагревать его со всех сторон. При определенной температуре в сосуде возникнут химические превращения.
Взаимодействие водорода с кислородом начинается со следующей эндотермической реакции:
H2 + О2 ® 2&ОН - 67 кДж/моль, зарождение цепи. (1)
Далее происходит развитие цепи:
Продолжение
&ОН + Н2 ® Н2О + Н& + 44 кДж/моль,(2)
Разветвление
Н& + О2 ® &ОН + &О& - 54 кДж/моль, (3)
&О& + H2 ® &ОН + Н&(4)
Н& + О2 + Н2 ® 2&ОН + Н& - 42 кДж/моль. (5)
То есть на каждой элементарной стадии процесса образуются один (продолжение) или два (разветвление цепи) радикала. Наконец, когда концентрация активных центров станет достаточно большой, все более заметны становятся реакции обрыва цепи:
Н& + &ОН ® Н2О, (6)
&ОН + Н& ® Н2О, (7)
Н& + Н& ® Н2, (8)
Н& + стенка ® обрыв, (9)
&ОН + стенка ® обрыв. (10)
Таким образом, окисление водорода представляет собой непрерывную и разветвляющуюся цепь последовательных превращений активных частиц (молекул, атомов, радикалов), т.е. радикально-цепной процесс с разветвлением. Цепь сильно ветвится, и концентрация активных центров лавинообразно нарастает, т.е. реакция самоускоряется, что в конечном итоге приводит к самовоспламенению.
В целом по аналогичному механизму, но несколько медленнее, протекают процессы окисления углеводородов, хотя в зависимости от вида горючего многие элементарные стадии будут различными. Окисление углеводородов обычно протекает по следующим типичным элементарным стадиям:
RH + О2 ® R& + НО2& зарождение цепи 11)
R& + О2 ® ROO& (или R’-CH-OO&) продолжение цепи 12)
т.е. образуется пероксидный радикал. Далее превращение этого радикала протекает по двум конкурирующим направлениям в зависимости от температуры. Так, при температурах ниже примерно 400 °С образуется гидропероксид:
ROO& + HR ® ROOH + R& 13)
который далее распадается на два новых радикала:
ROOH ® RO& + &ОН вырожденное разветвление 13а)
При температурах выше 400 °С часть пероксидных радикалов изомеризуется и, распадаясь, превращается в альдегид:
R’-CH2-OO& ® R’-&CH-О-OH ® R’-CHO + &ОН 14)
и далее - вырожденное разветвление:
R’-CHO + O2 ® R’-CO& +HO& (14а)
Вырожденное разветвление по реакциям (13) и (13а) протекает при низких давлениях и может привести к возникновению так называемых "холодных пламен", тогда как при высоких давлениях и температуре цепь разветвляется по реакциям (14) и (14а), и возникает "горячее" пламя. Горячие пламена от холодных отличаются также тем, что в них кроме конечных продуктов СО2 и Н2О в заметных количествах образуются оксид углерода СО, а также радикалы: С=С: и: СН&, при рекомбинации которых получается сажа. Процессы цепного самовоспламенения других органических горючих веществ во многом аналогичны.
Характерной особенностью разветвленных цепных реакций является незначительное количество активных центров, появляющихся в результате теплового движения молекул. Основная их часть образуется в результате разветвления цепи. Их концентрация n определяется скоростью начального инициирования цепи Wo, а также скоростью разветвления и обрыва цепей. Сумма этих трех скоростей представляет собой общую скорость образования активных центров. Тогда в дифференциальной форме выражение для скорости цепной разветвленной реакции окисления будет иметь следующий вид:
dn / dt = w0 + f×n - g×n = wo + (f-g)n, (15)
где Wo - скорость начального инициирования активных центров;
f - константа скорости разветвления цепи;
g - константа скорости обрыва цепи;
n - концентрация активных центров.
Скорость образования активных центров в начальной стадии зависит в известной степени от температуры и, в большей степени, от давления горючей смеси. Увеличение температуры повышает только скорость инициирования радикалов и скорость разветвления цепей. Скорость обрыва цепей от температуры не зависит, так как рекомбинация радикалов протекает без энергии активации. Изменение давления влияет, главным образом, на скорость обрыва цепей.
При низких давлениях преобладает обрыв цепей на стенках сосуда, при высоких - в объеме горючей смеси.
Если скорость разветвления цепи меньше скорости обрыва (f < g), то реакция протекает спокойно, как обычная цепная неразветвленная реакция (рис.1). Если же f > g, то в этом случае имеет место лавинообразное нарастание концентрации радикалов, а следовательно, и скорости самой реакции. Интегрирование уравнения (15) приводит к выражению:
n » wo/(f-g)×[exp(f-g)t-l], (16)
из которого видно, что через каждые t = 1/(f-g) сек концентрация радикалов n, а следовательно, и скорость цепной реакции возрастает в е раз, и за время порядка нескольких интервалов 1/(f-g) практически полное отсутствие реакции сменяется взрывным протеканием процесса. Иными словами, после некоторого периода индукции происходит самовоспламенение смеси.
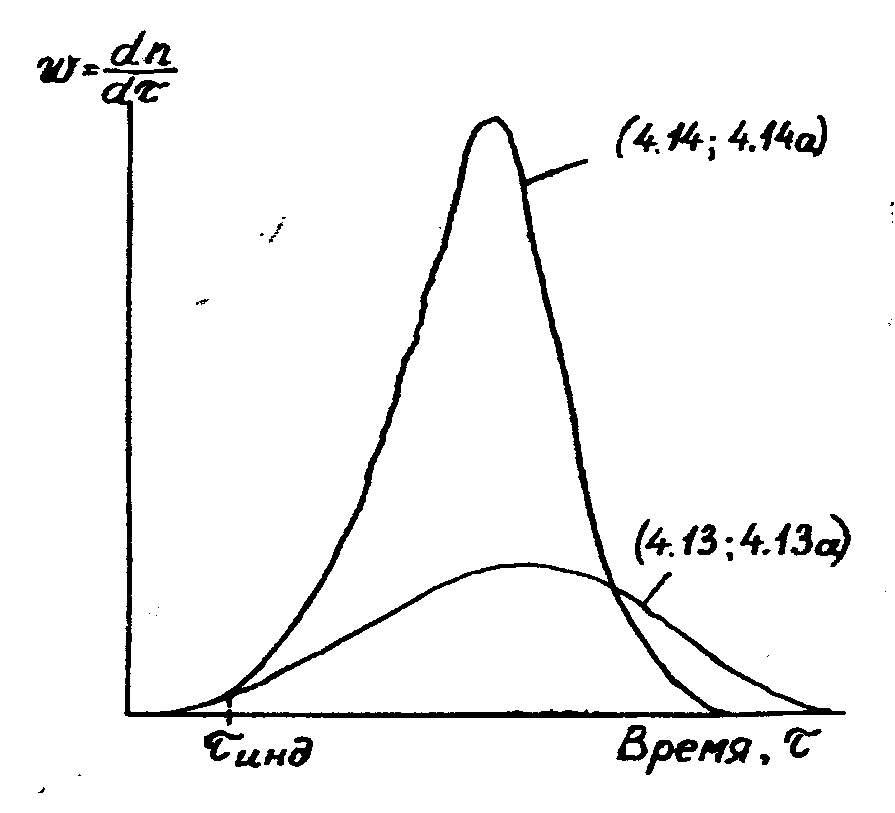
Рис. 1.1. Суммарная скорость разветвленных цепных реакций
Период индукции - это начальный период реакции, в течение которого скорость реакции неизмеримо мала, и который далее сменяется периодом быстрого развития химического превращения. То есть период индукции - это период накопления активных центров (рис.1.1).