| 3.1. Строение атома. Основные понятия и определения Атом – наименьшая неделимая химическими средствами частица химического элемента, обладающая его химическими свойствами, Dатома ≈ 10–10 нм. Атом – электронейтральная микросистема, состоящая из плотного, положительно заряженного ядра и взаимодействующих с ним отрицательно заряженных электронов. Ядро атома (Dядра ≈ 10–14–10–15 нм) состоит из двух типов частиц (нуклонов) – протонов и нейтронов. Протон (p) – элементарная частица, имеющая единичный, то есть наименьший по абсолютному значению, из существующих в природе, положительный заряд (+1). Характеристики протона: заряд qпротона=1,60219•10–19Кл; масса mпротона = 1,67265•10–24 г (1,00728 а.е.м.). Нейтрон (n) – элементарная частица, не имеющая электрического заряда; mнейтрона= 1,67495•10–24 г (1,00867 а.е.м.). Электрон – элементарная частица, имеющая единичный, неделимый далее отрицательный заряд, равный по модулю заряду протона (–1). Характеристики электрона: заряд qэлектр.=1,60217•10-19Кл, масса mэлектрона=0,91056•10–24г (1/1836,1 mпротона). Массу атомов и молекул выражают в виде относительной величины, в атомных единицах массы (а.е.м.) – углеродных единицах (у.е.). 1 а.е.м. = 1 у.е. = 1/12 части массы атома изотопа углерода (12С) = 1,66043×10-24 г Основная масса атома сосредоточена в ядре и характеризуется массовым числом А, равным сумме чисел протонов Z и нейтронов N: A = Z + N Заряд ядра –главная характеристика атома,определяется числомпротонов,находящихся в ядре. Атомный номер соответствует заряду ядра элемента (в периодической системе элементов Д.И. Менделеева – порядковому номеру элемента). Вид атомов с одинаковым зарядом ядра называется химическим элементом. Атом обозначается химическим символом элемента с индексами: левый нижний – атомный номер, т.е. заряд ядра (число протонов); левый верхний – массовое число: А Э Z Атомы, имеющие одинаковый заряд ядра, но разную массу, называются изотопами. Так, природный хлор состоит из двух изотопов: 35 Cl и 37Cl. Ион – атом или молекула, потерявший один или более электронов – катион (положительно заряженный ион, например,К+, Са2+, Al3+, NH4+), или, наоборот, присоединивший один или более электронов – анион (отрицательно заряженный ионCl–, S2–, NO3–, SO42–). |
| Основные положения квантовой химии Квантовая (волновая) механика –теоретическая основа учения о движении и взаимодействии микрообъектов (электронов, протонов и других частиц, обладающих ничтожной массой). Законы движения микрочастиц в квантовой химии выражены уравнением Шредингера, который применил волновую функцию Ψ, для описания движения электрона в трехмерном пространстве: ¶2Y ¶2Ψ ¶2Y 2m —— + —— + —— + ——— (Е – Еп)Ψ = 0 ¶x2 ¶y2 ¶z2 h2 где Е, Еп – соответственно полная и потенциальная энергия электрона; m – масса электрона; h – постоянная Планка; Y – волновая функция, квадрат модуля которой ïYï2 характеризует плотность вероятности нахождения электрона в соответствующей области пространства. Решение уравнения Шредингера в полярной системе координат даёт три независимые величины, которые называются квантовыми числами электрона: n, l, m, набор значений которых определяют пространственные и энергетические характеристики электрона в атоме. Число n называется главным, l – орбитальным, а m – магнитным квантовыми числами. Характеристика квантовых чисел и их значения представлены в таблице 3.1. Экспериментальные факты показывают, что электрон обладает собственным моментом количества движения, не связанным с движением электрона вокруг ядра, в связи с этим введено четвертое квантовое число s (или mS), названное спиновым квантовым числом. ******************* Атомные орбитали (АО) – это пространство вокруг ядра в атоме, в котором наиболее вероятно пребывание электрона (рис. 3.1). Для полного описания АО надо указать: 1) номер энергетического уровня орбитали n (главное квантовое число), 2) тип орбитали– характеризуетсяорбитальным квантовым числом l, каждому значению l соответствует орбиталь особой формы (подуровни): при l = 1– сфера – это s -орбиталь, l = 2 – гантель – p -орбиталь, l = 3 – сдвоенная гантель – d -орбиталь, l = 4 – еще более сложная форма – f -орбиталь. 3) пространственную ориентацию орбиталей одного типа, ориентированных вдоль соответствующих осей координат – характеризуетсямагнитным квантовым числом m. |
Таблица 3.1
ХАРАКТЕРИСТИКА КВАНТОВЫХ ЧИСЕЛ И РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ ПО АО
ПЕРВЫХ ЧЕТЫРЕХ ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ
| Наименование | Физический смысл (что описывает) | Значение чисел | Энергетические уровни | Примечание | ||||||||
| Главное квантовое число n | 1.Энергетический уровень 2.Запас энергии электрона на данном уровне 3.Размер атома | Буквенное обозначение 1 ÷ ∞ | К | L | M | N | Значения n, l, m определяют квантовое состояние электрона в атоме. Набор значений n, l, m называют квантовой ячейкой | |||||
 Орбитальное квантовое число l Орбитальное квантовое число l
| 1.Энергетический подуровень 2.Изменение энергии в пределах энергетического подуровня 3.Форму орбитали | 0÷(n –1) | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f |
| Магнитное квантовое число m | 1.Пространственная ориентация орбитали 2.Определяет количество орбиталей на энергетическом подуровне | - l ÷ 0 ÷ + l | -1 +1 | -1 +1 | -2 -1 +1 +2 | -1 +1 | -2 -1 +1 +2 | -3 -2 -1 +1 +2 +3 | ||||
| Спиновое квантовое число s | Проекция собственного момента количества движения электрона на избранное направление | ±1/2 | ||||||||||
| Максимальное число электронов на подуровне | ||||||||||||
| Максимальное число электронов на уровне | N = 2n2 |
 . .  s -орбиталь p -орбитали
s -орбиталь p -орбитали
 d -орбитали
d -орбитали
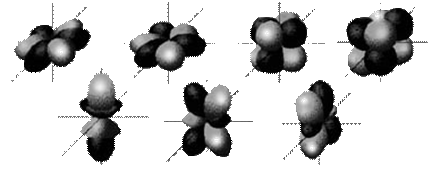 f -орбитали
Рис. 3.1. Формы и пространственная ориентация атомных s -, p -, d - и f -орбиталей.
Электронная структура атомов
Заполнение энергетических уровней и подуровней происходит согласно принципу минимальной энергии: первыми заполняются орбитали с минимальным уровнем энергии. Минимальной энергией обладают уровни и подуровни, ближайшие к ядру.
Последовательности заполнения энергетических уровней и подуровней задается правилами В.М. Клечковского:
минимальной энергии соответствует минимальное значение суммы (n + ℓ), то есть при увеличении заряда ядра атома заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы (n + l) к орбиталям с большим значением суммы(n + l);
если эта сумма для двух электронов одинакова, то минимальная энергия (Emin) соответствует минимальному значению n, то есть при одинаковых значениях суммы (n + l) заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа.
Следовательно, увеличение энергии происходит в следующей последовательности: Emin: 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f≈5d<6p<7s.
f -орбитали
Рис. 3.1. Формы и пространственная ориентация атомных s -, p -, d - и f -орбиталей.
Электронная структура атомов
Заполнение энергетических уровней и подуровней происходит согласно принципу минимальной энергии: первыми заполняются орбитали с минимальным уровнем энергии. Минимальной энергией обладают уровни и подуровни, ближайшие к ядру.
Последовательности заполнения энергетических уровней и подуровней задается правилами В.М. Клечковского:
минимальной энергии соответствует минимальное значение суммы (n + ℓ), то есть при увеличении заряда ядра атома заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы (n + l) к орбиталям с большим значением суммы(n + l);
если эта сумма для двух электронов одинакова, то минимальная энергия (Emin) соответствует минимальному значению n, то есть при одинаковых значениях суммы (n + l) заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа.
Следовательно, увеличение энергии происходит в следующей последовательности: Emin: 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f≈5d<6p<7s.
|
Распределение электронов по АО определяется принципом Паули: в атоме не может быть даже двух электронов с одинаковым набором значений всех квантовых чисел.
Следовательно, на каждой орбитали не может быть более двух электронов с противоположными значениями спиновых квантовых чисел ¯. Это спаренные электроны, в отличие от одного электрона – неспаренного: или ¯.
В пределах энергетического подуровня заполнение идет в соответствии с правилом Гунда (Hund): устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина электронов является максимальным.
Например: для электронной конфигурации 2р3 возможны следующие варианты размещения электронов:
1 2 3
Только в первом случае достигается максимальный суммарный спин (½+½+½=3/2). Это – энергетически самое выгодное состояние системы. Электронная конфигурация (формула) атома – распределение электронов по орбиталям в основном (невозбужденном) состоянии этого атома и его ионов. Число электронов на орбиталях данного подуровня указывается в верхнем индексе справа от буквы, например 3 d 5 – это 5 электронов на 3 d -подуровне. Так, электронная формула атома хлора 17 Cl: 1 s 22 s 22 p 63 s 23 p 5. Для краткости записи электронной конфигурации атома вместо орбиталей, полностью заселенных электронами, записывают символ благородного (инертного) газа, имеющего соответствующую электронную формулу (за скобки вынесены валентные электроны, принимающие участие в образовании химических связей). Например, электронную формулу атома хлора 17 Cl можно записать: [Ne]3 s 23 p 5 , где [Ne] = 1 s 22 s 22 p 6. | ||||||||||||||||||||||||||||||
3.2. Периодическая система элементов Д.И. Менделеева
Периодический закон, открытый Д. И. Менделеевым в 1869 году, устанавливал зависимость между свойствами элемента и атомным весом.
С развитием квантовой механики закон получил новую формулировку: свойства простых веществ, а так же формы и свойства соединений находится в периодической зависимости от величины зарядов ядер их атомов.
Графическое отображение периодического закона – периодическая систем элементов, в которой порядковый номер элемента равен количеству протонов ядра атома.
Периодическая система элементов Д.И. Менделеева состоит из семи периодов (горизонтальные ряды) и восьми групп (вертикальные столбцы).
Период – последовательный ряд элементов, размещенных в порядке возрастания заряда ядра атомов, электронная конфигурация которых изменяется от ns1 до ns2p6 (или ns2 у первого периода).
Периоды начинаются с s-элементов и заканчиваются p-элементами (у первого периода – s-элементом). В периодах свойства элементов изменяются последовательно от типичных металлов до типичных неметаллов.
Группы – это вертикальные ряды элементов, имеющих одинаковую конфигурацию валентных электронов. Каждая группа разбивается на две подгруппы: главную (составляют s- и p-элементы) и побочную (составляют d-элементы). Элементы, расположенные в одной и той же группе благодаря одинаковой конфигурации валентных электронов имеют сходные химические свойства. Их называют «элементы-аналоги ».
В шестом периоде после лантана (порядковый номер 57) следуют 14 элементов с порядковыми номерами 58–71, называемые лантаноидами, так как в химическом отношении они сходны с лантаном.
В седьмом периоде после актиния (порядковый номер 89) расположены 14 элементов с порядковыми номерами 90–103 (актиноиды). Лантаноиды и актиноиды (¦-элементы) вынесены вниз таблицы, в отдельные две строки
Геометрические и энергетические характеристики атомов
радиус атома – это расстояние от ядра до главного максимума плотности внешних электронных оболочек. С увеличением заряда ядра в периодах атомный радиус немонотонно уменьшается, а в группах увеличивается:
Энергия ионизации (Еи) – энергия, необходимая для отрыва электрона от атома. Чем меньше Еи, тем легче атом отдает электрон при образовании химической связи, т.е. элемент является более сильным восстановителем. Восстановительная способность нейтральных атомов с ростом заряда ядра в периоде уменьшается, в главных подгруппах растет, а в побочных – падает. Энергия сродства к электрону (Еср) – энергия, выделяющаяся при присоединении электрона к нейтральному атому. Чем больше Еср, тем более сильным окислителем является данный элемент. В таблице Д.И. Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх. Электроотрицательность элемента (эо) – условная величина, характеризующая способность атома в химическом соединении притягивать к себе электроны. Поэтому ЭО атома должна быть пропорциональна как энергии ионизации, так и энергии сродства к электрону. С ростом порядкового номера элемента в периодах ЭО растет, а в подгруппах, как правило, падает, например:
Элементы с высокой ЭО–типичные неметаллы; элементы с наименьшей ЭО представляют собой типичные в химическом смысле металлы.
|
Примеры решения задач
Пример 1. Составьте электронные формулы (в порядке заполнения орбиталей) атомов калия, кальция, скандия, мышьяка и церия. К какому семейству элементов принадлежит каждый из них? Каковы их валентные возможности?
Решение. Атомы калия и кальция имеют электронное строение:
19 К 1s22s22p63s23p64s1, 20Ca 1s22s22p63s23p64s2
Оба элемента принадлежат к s-элементам, так как последний по заполнению электрон размещается на s-подуровне. Валентными будут s-электроны, соответственно один электрон у атома K и два электрона у атома Ca.
Строение атома скандия: 21 Sc 1s22s22p63s23p64s23d1. В этом случае сначала заполняется 4s-подуровень, а затем 3d-подуровень. Скандий d-элемент. У этого элемента три валентных электрона, которые имеют конфигурацию 3d14s2.
Атом мышьяка: 33As 1s22s22p63s23p64s23d104p3. Это – p-элемент. Валентных электронов у атома мышьяка пять, они имеют конфигурацию 4s24p3, поэтому As может проявлять валентность, равную трем и пяти.
Атом церия: 58Ce 1s22s22p63s23p64s23d104p65s24d105p66s24f2. Церий –
f-элемент, конфигурация валентных электронов 4f26s2 , он может проявлять валентность, равную двум и четырем.
Пример 2. Составьте электронные формулы атома элемента с порядковым номером 12, находящегося в нормальном и возбужденном состояниях. Укажите координаты элемента в периодической системе и значения всех квантовых чисел валентных электронов.
Решение. У атома данного элемента 14 электронов. Они расположены:
| в нормальном состоянии – электронная формула: 1s22s22p63s23p2; | в возбужденном состоянии – электронная формула: 1s22s22p63s13p3; |
электронно-структурная формула:
3s 3р
 2 s 2р
1s 2 s 2р
1s
| электронно-структурная формула:
3 s 3р
 2 s 2р
1s 2 s 2р
1s
|
Элемент находится в третьем периоде (так как последний по заполнению
уровень – третий), в четвертой группе (сумма s- и p-электронов последнего уровня равна 4), главной подгруппе (так как это p-элемент). Валентными являются все четыре электрона, находящиеся на третьем s- и p-подуровнях. Максимальная валентность равна четырем.
Квантовые числа валентных электронов атома в возбужденном состоянии:
N l m s
3s1 3 0 0 1/2
 3p3 3 1 –1, 0, +1 1/2
3p3 3 1 –1, 0, +1 1/2
для каждого ē для каждого ē
| 3.3. Типы химической связи и ее свойства Ковалентная связь. При образовании ковалентной связи между атомами их валентные электроны обобществляются и локализуются между ними. Разработанная на этой основе теория химической связи получила название метода валентных связей (МВС). Основные положения МВС: 1. Химическая связь осуществляется электронными парами. 2. В образовании связи участвуют только неспаренные электроны (валентные электроны) с противоположными спинами. 3. Связь тем прочнее, чем в большей степени перекрываются электронные орбитали. |
Основные характеристики химической связи
1) кратность химической связи – число общих электронных пар, соединяющих два атома в молекуле: Н–Н; Cl–Cl; Na–F; С=О; О=О; NºN;
2) энергия разрыва связи (прочность связи)– энергия, необходимая для разрыва химической связи в молекуле; чем больше энергия разрыва связи (Е, кДж/моль), тем прочнее связь:
Н2 F2 N2
Е, кДж/моль 436 151 940
3) длина связи (d, нм)– межъядерное расстояние в молекуле; чем больше кратность связи, тем меньше ее длина при прочих равных условиях:
Э–Н NH3PH3 AsH3 SbH3
d, нм 0,101 0,142 0,152 0,170
4) насыщаемость ковалентной связи – способность атома участвовать в образовании ограниченного числа ковалентных связей, определяемая валентными возможностями атома:
ненасыщенная связь насыщенная связь
: C=O О=С=О
5) направленность связи – определяется валентными углами, которые образуются между химическими связями при образовании молекул, состоящих из трех и более атомов:
линейная молекула плоская молекула объемная молекула
 Cl–Mg–Cl О Н
Н Н |
Н–С–Н
|
Н
Химическая связь, образованная перекрыванием АО расположенных вдоль прямой линии, проведенной через ядра взаимодействующих атомов, называется s(сигма)– связью. Одинарная связь – всегда s-связь.
s-Связи строго ориентированы в пространстве, поэтому в зависимости от состава молекулы они могут находиться под определенным углом друг к другу. Углы между s - связями называются валентными углами. Cl–Mg–Cl О Н
Н Н |
Н–С–Н
|
Н
Химическая связь, образованная перекрыванием АО расположенных вдоль прямой линии, проведенной через ядра взаимодействующих атомов, называется s(сигма)– связью. Одинарная связь – всегда s-связь.
s-Связи строго ориентированы в пространстве, поэтому в зависимости от состава молекулы они могут находиться под определенным углом друг к другу. Углы между s - связями называются валентными углами.
|
p(пи)-связи.
Помимо s- и p-связей возможно образование еще одного вида связи –
Связи располагаются по возрастанию их энергий в следующий ряд: s » p > d. | |||||||||
Типы ковалентной связи:
1) неполярная ковалентная связь – образуется в простых веществах – общая электронная пара расположена на равном расстоянии (симметрично) от ядер атомов
| |||||||||
| 2) полярная ковалентная связь – образуется между атомами разных элементов, где общее электронное облако смещено к атому элемента c большей относительной электроотрицательностью (эо). Возникает асимметрия в распределении положительных и отрицательных зарядов взаимодействующих атомов, и вся двухатомная молекула представляет собой электрический диполь. | |||||||||
Молекула HCl: H 1s1 (э.о. = 2,10), Cl 1s22s22p63s23p5 (э.о. = 2,83)
 Н· + Cl· → H+δ:Cl–-δ. Н· + Cl· → H+δ:Cl–-δ.
| |||||||||
| Электронная пара смещена к Cl, молекула Н-Cl – диполь: у атома хлора возникает эффективный отрицательный заряд(–0,18 заряда электрона), а у атома водорода – эффективный положительный заряд(+0,18 заряда электрона). Расстояние между центрами тяжести эффективных зарядов (+q и –q) называется длиной диполя l. Мерой полярности связи является дипольный момент μ, представляющий собой произведение эффективного заряда (еэф.) на расстояние (l) между электрическими центрами тяжести противоположных зарядов μ= еэф. •l Обычно μ измеряется в Дебаях (D): 1D= 3,33•10–30 Кл•м. | |||||||||
3) донорно-акцепторный механизм образования ковалентной связи – связь образуется за счет того, что один атом представляет пару электронов (донор),а второй атом принимает ее на вакантную орбиталь(акцептор)
Образование молекулы NH4Cl: NH3 + HCl = NH4Cl
  N 1s22s22p3, H 1s0
H H +
| |
: N–H + H+ → H–N–HилиNH+4.
| |
H H N 1s22s22p3, H 1s0
H H +
| |
: N–H + H+ → H–N–HилиNH+4.
| |
H H
| |||||||||
Гибридизация атомных орбиталей— это выравнивание (усреднение) энергии различных АО в атоме в результате их смешивания (гибридизации) перед химическим взаимодействием (или в его процессе), что приводит к образованию гибридных орбиталей атома:
 Процесс гибридизации можно представить в виде трехвзаимосвязанных этапов: а) возбуждение атома; б) гибридизация орбиталей возбужденного атома;
Процесс гибридизации можно представить в виде трехвзаимосвязанных этапов: а) возбуждение атома; б) гибридизация орбиталей возбужденного атома;  в) образование гибридных связей. На этапах аи б энергия затрачивается, на этапе в – выделяется. Если энергия, затраченная на первых двух этапах, компенсируется в процессе образования связей, то гибридизация осуществляется.
Типы гибридизации:
1) sp -гибридизация: происходит возбуждение ns2 np0 ® ns1 np1, в гибридизации участвуют одна s - и одна p -орбитали, образуются две sp-гибридных орбитали, имеющих линейную симметрию; этому типу гибридизации соответствует образование линейной молекулы, например, ВеН2: в) образование гибридных связей. На этапах аи б энергия затрачивается, на этапе в – выделяется. Если энергия, затраченная на первых двух этапах, компенсируется в процессе образования связей, то гибридизация осуществляется.
Типы гибридизации:
1) sp -гибридизация: происходит возбуждение ns2 np0 ® ns1 np1, в гибридизации участвуют одна s - и одна p -орбитали, образуются две sp-гибридных орбитали, имеющих линейную симметрию; этому типу гибридизации соответствует образование линейной молекулы, например, ВеН2:

|
2) sp2-гибридизация: происходит возбуждение ns2 np1 ® ns1 np2,
p-орбитали, образуются три sp2-гибридных орбитали, лежащие в одной плоскости и ориентированные под углами 120 0 друг к другу имеющих линейную симметрию; это- му типу гибридизации соответствует обра- зование плоской треугольной молекулы, например, BF3; | ||
3) sp3-гибридизация: происходит возбуждение ns2 np2 ® ns1 np3, в гибридизации участвуют одна s- и три p-орбитали, образуются четыре sp3-гибридных орбитали, вытянутые в направлении к вершинам тетраэдра, т.е. ориентированные под углом 109 029 ′ друг к другу. Этому типу гибридизации соответствует образование молекулы в форме тетраэдра, например, СН4:
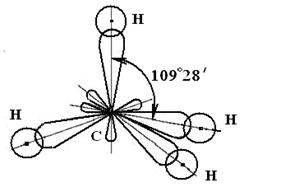
| ||
| Водородная связь – химическая связь, характерная для атома водорода, связанного непосредственно с наиболее электроотрицательными элементами (F, O, N). Межмолекулярная водородная связьвозникает между водородом и электроотрицательным элементом другой молекулы (например, в молекуле Н2О, где атом кислорода имеет значительный эффективный отрицательный заряд –d, а ядро атома водорода – эффективный положительный заряд + d, между атомом водорода и атомом кислорода соседней молекулы возникает электростатическое притяжение, что и приводит к образованию водородной связи): Н ― Оδ- … Нδ+ │ │ +δН … О δ-― Н | ||
| Ионной химической связью называют связь, которая образуется в результате электростатического взаимодействия между катионом и анионом. В соответствии с теорий ионной связи при взаимодействии элементов, имеющих резко отличающиеся значения электроотрицательностей, протекают следующие процессы: образование ионов взаимодействующих атомов: К0 - e ® K+ ; А0 + е ® А-. образование молекулы происходит за счет электростатического притяжения образовавшихся ионов: К+ + А- = КА. Ионная химическая связь – предельный случай полярной химической ковалентной связи, которому отвечает значительное смещение пары электронов связи к наиболее электроотрицательному атому (аниону). Ионная связь в отличие от ковалентной связи не направлена и не насыщаема. | ||
| Металлическая связь.С точки зрения современных представлений, при сближении атомов металлов, в результате образования кристаллической решетки, валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются с одной орбитали на другую, осуществляя связь между всеми ионами кристалла металла. Такой тип химической связи называется металлической связью (Ме–Ме).Связь делокализована, т. е. электроны, осуществляющие металлическую связь, обобществлены ("эл«ктронный газ") » перемещаются по всему объему металла, в целом электронейтральному, обеспечивая связь между атомами. |
Примеры решения задач
Пример 1.
В каком из соединений серы – K2S, H2S, CS2 – образуются наиболее полярные химические связи? Укажите, в сторону какого атома происходит смещение электронной плотности связи.
Решение. Используя значения относительных электроотрицательностей элементов (см. приложение), находим разности относительных электроотрицательностей серы и элементов, образующих с нею химическую связь:
а ) сера–калий: 2,6 – 0,91 = 1,69, смещение в сторону атома серы;
б) сера–водород: 2,6 – 2,1 = 0,5, смещение в сторону атома серы;
в) сера–углерод: 2,6 – 2,5 = 0,1, смещение в сторону атома серы.
Чем больше по абсолютному значению разность относительных электроотрицательностей, тем более полярна связь. В данном примере наиболее полярной является связь сера–калий, а наименее полярной – связь сера–углерод.
Пример 2.
Укажите характер связей в молекуле СО2 и их взаимное расположение ..
Решение. Запишем электронные формулы атомов кислорода и углерода (в нормальном и возбужденном состояниях):
O 1s22s22p4; С 1s22s22p2; С* 1s22s12p3.
Каждая связь между атомами О и С двойная (одна s и одна p), для образования двух p-связей потребуется участие двух p-орбиталей атома углерода. Оставшиеся s- и p-орбитали дают две sp-гибридные орбитали, образующие угол 1800. Молекула СО2 линейна, а дипольный момент молекулы равен нулю:

или О ═ С ═ О
Пример 3.
Определите тип гибридизации орбиталей атомов углерода в молекулах этана С2Н6, этилена С2Н4 и ацетилена С2Н2 и изобразите геометрическую форму этих молекул.
Решение.
В органических соединениях атом углерода всегда имеет валентность, равную четырем, следовательно, находится в возбужденном состоянии
С 1s22s12p3. Структурная формула молекулы этана: Н Н
½ ½
Н – С – С – Н
½ ½
Н Н
В молекуле этана семь σ- связей. Шесть связей С–Н образованы в результате перекрывания sp3 -гибридных орбиталей атомов углерода с 1s -орбиталями шести атомов водорода. Седьмая связь – между углеродными атомами – образуется за счет перекрывания sp3 -гибридных орбиталей атомов углерода.
Молекула этилена имеет структурную формулу: Н – С ═ С – Н.
½ ½
Н Н
Атомные орбитали (АО) каждого из атомов углерода находятся в sp2- гибридном состоянии – есть имеет место гибридизация одной s- и двух p- атомных орбиталей углерода с образованием трех гибридных орбиталей, расположенных в одной плоскости под углом 1200. У каждого атома углерода остается по одному p-электрону, не принявшему участие в гибридизации.
|
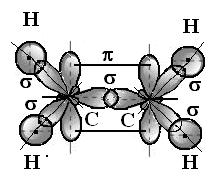
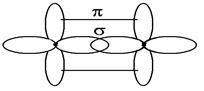
к плоскости молекулы, и приводит к образованию π -связи. Следовательно, в молекуле этилена имеется двойная связь, представляющая сочетание σ - и π -связей.
Молекула ацетилена имеет структурную формулу: Н – С ≡ С – Н.
В молекуле ацетилена атомы углерода, связанные тройной связью, находятся в состоянии sp- гибридизации. В этом случае происходит гибридизация одной s- и одной p- атомных орбиталей углерода с образованием двух эквивалентных гибридных орбиталей, расположенных на одной линии. Угол между осями этих орбиталей составляет 1800. При этом у каждого атома углерода остается по два 2p-электрона, не принявших участие в гибридизации и расположенных в двух взаимно перпендикулярных плоскостях. При этом σС-С -связь образуется при перекрывании двух sp- гибридных АО между собой;
σС-Н - связи образуются при перекрывании sp-гибридных АО углерода с s-орбиталями атомов водорода. В этой молекуле все атомы лежат на одной прямой и молекула является линейной.
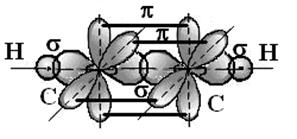
Не вступившие в гибридизацию р-электронные орбитали одного атома углерода взаимно перекрываются с аналогичными орбиталями другого атома так, что образуются две π -связи, причем каждая в своей плоскости. Угол между плоскостями π -орбиталей составляет 90 0.Таким образом, тройная связь в молекуле ацетилена состоит из σ -связи и двух π -связей.
**********************************************