Лекция 1
МАССООБМЕННЫЕ ПРОЦЕССЫ
ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
Введение
В химической технологии широко распространены и имеют большое значение массообменные процессы.
Сущность любого массообменного процесса состоит в переходе одного или нескольких компонентов смеси из одной фазы в другую при взаимодействии этих фаз.
Подавляющее большинство массообменных процессов протекает при непосредственном контакте фаз, причём такие процессы можно разделить на 2 группы:
1. Процессы со свободной (подвижной) границей раздела фаз.
К ним относятся:
▫ абсорбция газов и паров жидкостями;
▫ ректификация жидких смесей;
▫ экстракция жидкостная, то есть извлечение вещества, растворённого в одной жидкости, другой жидкостью.
2. Процессы с фиксированной (неподвижной) границей раздела фаз или процессы с участием твёрдой фазы.
К ним относятся:
▫ адсорбция газов и паров твёрдым поглотителем;
▫ растворение твёрдых веществ в жидкостях и экстрагирование жидкостями отдельных компонентов из твёрдой фазы – выщелачивание;
▫ кристаллизация, то есть выделение твёрдых веществ из растворов и расплавов;
▫ сублимация (возгонка) твёрдых веществ;
▫ сушка, то есть удаление жидкости из твёрдых тел.
Как и прежде, рассматриваться будут не специальные, а только основные процессы и аппараты, то есть процессы и аппараты, общие для различных отраслей химической промышленности.
Например, упомянутый процесс абсорбции широко распространён как в технологии неорганических веществ, так и в органическом синтезе.
Основные задачи, решаемые с помощью массообменных процессов в химической технологии:
▫ извлечение компонентов из смесей с получением или целевых продуктов, или полупродуктов;
▫ очистка различных веществ или сред от загрязняющих компонентов.
Например, синтез аммиака осуществляют из азотоводородной смеси, которую получают разделением воздуха и конверсией природного газа. При этом образуется смесь газов: N2 + H2 + CO + CO2 + H2S + NO+ NO2. Серо- и кислородсодержащие компоненты этой смеси являются ядом для катализатора синтеза аммиака, в связи с чем их из смеси извлекают. Но извлекаемые компоненты сами по себе полезны. (Кто-то сказал, что «грязь – это полезное вещество, только лежит не там, где надо»). Так, выделив СО2, есть возможность получать «сухой лёд», или направить диоксид углерода на синтез карбамида. Так рождается безотходная технология.
В подавляющем большинстве случаев производственные установки химической промышленности создают по блок-схеме:
 |
Очевидно, массообменные процессы играют определяющую роль на 1-ой и 3-ей стадиях производства.
Без надлежащей подготовки сырья не достигается требуемая степень конверсии в реакторе; без надлежащего разделения реакционной смеси не приходится говорить о качестве продукции.
Подсчитано, что на долю оборудования для массообменных процессов в химической промышленности приходится примерно 50 % всех капитальных вложений.
Завершая вводную часть, отмечу особую экологическую роль массообменных процессов очистки в охране окружающей среды от вредных промышленных выбросов и стоков. Причём выбросов не только самой химической промышленности, но и электроэнергетики, электроники, металлургии, автомобилестроения и проч.
Основные понятия и определения
Определим основные понятия теории массообмена.
Тело или группу тел, находящихся во взаимодействии и мысленно обособляемых от окружающей среды, называют системой.
Если внутри системы нет поверхностей раздела, отделяющих части системы друг от друга, то такая система называется гомогенной. Если же такие поверхности раздела имеются, то система называется гетерогенной.
Термином фаза обозначается совокупность всех гомогенных частей системы, отделённая от других частей поверхностью раздела.
Например, смесь газов или раствор состоит из одной фазы, а система «лёд – вода – водяной пар» состоит из трёх фаз, независимо от того, находится ли лёд в виде одного куска или в виде нескольких.
Любая гетерогенная система содержит не менее двух фаз.
Компонентом называется каждое содержащееся в системе химически однородное вещество, которое может быть выделено из неё и может существовать в изолированном виде длительное время.
Например, для водного раствора хлорида натрия компонентами являются вода и хлорид натрия. Ионы же натрия и хлора не могут рассматриваться как компоненты; ни те, ни другие не могут существовать как отдельные вещества.
Предположим, что во взаимодействии находятся жидкая и газовая (или паровая) фазы, а некоторый компонент может переходить из одной фазы в другую.
Условимся здесь обозначать содержание переносимого компонента в жидкой фазе символом «х », а содержание этого же компонента в газовой (паровой) фазе символом «у ».
Фактические концентрации «х » и «у » называют действительными или рабочими концентрациями компонента в фазах.
В соответствии со II законом термодинамики состояние замкнутой системы при взаимодействии двух фаз стремится к равновесию, то есть к состоянию, при котором количество молекул компонента, переходящих, например, из жидкости в газ и из газа в жидкость за определённый интервал времени одинаково.
Следовательно, при данной температуре и при данном давлении в условиях равновесия некоторой концентрации компонента в жидкой фазе «х » соответствует строго определённая концентрация этого же компонента «у *» в газовой (паровой) фазе. И наоборот, некоторой концентрации компонента в газовой (паровой) фазе «у » соответствует строго определённая при данной температуре и при данном давлении концентрация этого же компонента «х *» в жидкой фазе.
Связь между концентрациями компонента в фазах при равновесии выражается уравнениями равновесия, которые, в самой общей форме, имеют вид:
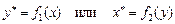 . (1.1)
. (1.1)
Примечание: «звёздочка» у символов концентрации «х » или «у » – условный значок, показывающий, что речь идёт именно о равновесной концентрации.
Отклонение состояния системы от равновесия, то есть условие
 (1.2)
(1.2)
является необходимым и достаточным условием для протекания массообменного процесса.
Способность рассматриваемого компонента к выходу из данной фазы (испарением, кристаллизацией и т. п.) характеризует химический потенциал — m. Переход компонента может происходить самопроизвольно только из фазы, в которой его химический потенциал больше, в фазу с меньшим химическим потенциалом.
Если внутри фазы возникает градиент химического потенциала, то количество компонента "А" (п А), переносимого за единицу времени через поверхность площадью d S, пропорционально градиенту химического потенциала и составляет
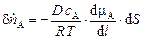 , (1.3)
, (1.3)
где D – коэффициент молекулярной диффузии [м2/с];
с А – молярная концентрация компонента "А" [(моль А)/м3];
l – расстояние по нормали к поверхности площадью d S.
Выражая химический mА через молярную долю компонента "А" (х А) и коэффициент активности (gА) посредством уравнения
 , (1.4)
, (1.4)
можно получить:
 . (1.5)
. (1.5)
Если принять, что коэффициент активности gА не зависит от молярной доли х А, то d lngA/d x A = 0, и тогда
 . (1.6)
. (1.6)
Последнее уравнение выражает известный 1-ый закон Фика [1] молекулярной диффузии, причём в нём градиент химического потенциала приближённо заменён градиентом концентрации.
Знак «минус» указывает на то, что перенос компонента происходит в направлении уменьшения концентрации.
Заметим, что закон Фика молекулярной диффузии является аналогом закона Ньютона внутреннего трения и закона Фурье теплопроводности.
Итак, поскольку химические потенциалы компонентов неидеальных смесей являются сложными функциями состава, то при анализе процессов массопередачи обычно рассматривают изменение не химических потенциалов, а изменение концентраций компонентов. Это оправдывается тем, что концентрации компонентов поддаются непосредственному определению (измерению) и чаще всего рассматриваются как параметры состоянии двух- и многокомпонентных систем.
Способы выражения составов многокомпонентных смесей
Состав многокомпонентной смеси — раствора, смеси газов или паров, многокомпонентного твёрдого вещества — и, в частности, содержание в ней какого-либо компонента, может выражаться разными способами: как с помощью безразмерных единиц — долей или процентов, так и через размерные величины — концентрации.
В теории массообмена наиболее употребительны следующие величины, выражающие содержание компонента в системе:
1. Объёмная доля — безразмерное отношение объёма компонента "А" ко всему объёму системы.
Обозначение объёмной доли компонента — «j».
Формально доля — безразмерное отношение, но фактически единицей измерения объёмной доли является: [(м3 А)/(м3 смеси)].
2. Молярная доля — безразмерное отношение количества вещества компонента "А" к количеству вещества системы.
Обозначения: молярная доля компонента в жидкой фазе — «х », в газовой (паровой) фазе — «у ».
В строгой записи у символа доли «х » или «у » (впрочем, как и у символа объёмной доли «j»), должен фигурировать нижний индекс «А».
Фактическая единица измерения молярной доли: [(моль А)/(моль смеси)].
3. Массовая доля — безразмерное отношение массы компонента "А" ко всей массе системы.
Обозначения: массоваядоля компонента в жидкой фазе — « », в газовой (паровой) фазе — «
», в газовой (паровой) фазе — « ».
».
Заметим, что в теории массообмена используются специфические обозначения массовой доли: не «w », как это принято в химии, а « » или «
» или « ». Это обусловлено тем, что обычно требуется обозначить не только способ выражения состава (здесь — массовая доля), но и указать, в какой именно фазе содержится компонент, а в дополнение к этому — в каком именно месте аппарата (на входе, на выходе, в другом определённом месте аппарата) таково содержание компонента. Применение буквы «w » потребовало бы обилия соответствующих индексов.
». Это обусловлено тем, что обычно требуется обозначить не только способ выражения состава (здесь — массовая доля), но и указать, в какой именно фазе содержится компонент, а в дополнение к этому — в каком именно месте аппарата (на входе, на выходе, в другом определённом месте аппарата) таково содержание компонента. Применение буквы «w » потребовало бы обилия соответствующих индексов.
Фактическая единица измерения массовой доли: [(кг А)/(кг смеси)].
4. Молярная концентрация — величина, равная отношению количества вещества компонента "А" ко всему объёму системы.
Используемый в химии термин «молярность» – синоним термина «молярная концентрация», – в теории массообмена не применяется.
Обозначения: молярная концентрация компонента в жидкой фазе — «сх », в газовой (паровой) фазе — «су ».
Единица измерения молярной концентрации: [(моль А)/м3].
5. Массовая концентрация — величина, равная отношению массы компонента "А" ко всему объёму системы.
Обозначения: массовая концентрация компонента в жидкой фазе — « », в газовой (паровой) фазе — «
», в газовой (паровой) фазе — « ».
».
Как видим, в теории массообмена для обозначения массовой концентрации принят символ « » (вероятно, по аналогии с символами массовой доли — «
» (вероятно, по аналогии с символами массовой доли — « » или «
» или « »), а не «rА» — символ, используемый в химии.
»), а не «rА» — символ, используемый в химии.
Единица измерения массовой концентрации: [(кг А)/м3].
6. Молярное отношение — безразмерное отношение количества вещества компонента "А" к количеству других веществ системы.
Обозначения: молярное отношение компонента в жидкой фазе — «Х », в газовой (паровой) фазе — «Y ».
Фактическая единица измерения: [(моль А)/(моль В)], где символом "В" обозначены все вещества смеси за исключением "А".
7. Массовое отношение — безразмерное отношение массы компонента "А" к массе остальных компонентов системы.
Обозначения: массовое отношениекомпонента в жидкой фазе — « », в газовой (паровой) фазе — «
», в газовой (паровой) фазе — « ».
».
Фактическая единица измерения: [(кг А)/(кг В)].
Разнообразие в способах выражения составов фаз продиктовано тем, что, в силу специфики того или иного массообменного процесса, его расчёт удобнее выполнять с использованием определённого выражения содержания компонента. В то же время, исходная информация может быть представлена в иных единицах измерения концентрации.
Так, например, содержание компонента в газовой фазе часто указывается в объёмных долях потому, что именно в объёмных долях отградуированы шкалы многих приборов – газоанализаторов.
Соотношения между различными способами выражения составов многокомпонентных смесей
Установить соотношения между различными способами выражения содержания компонента в системе несложно.
Если содержание компонента "А" в газовой фазе задано как объёмная доля, то в 1 м3 газовой смеси содержится jА [м3 компонента "А"] и (1 – jА) [м3 компонента "В"]. В этом случае объёмное отношение компонента "А":
 . (2.1)
. (2.1)
Следовательно, массовое отношение компонента "А" в смеси:
 . (2.2)
. (2.2)
Поскольку для определения плотности газа при рабочих условиях почти всегда используются справочные данные о плотности при нормальных физических условиях (r0) и уравнение Клапейрона – Менделеева, то
 . (2.3)
. (2.3)
Тогда молярное отношение компонента "А" в газовой смеси:
 , (2.4)
, (2.4)
где М А и М В – молярные массы компонентов "А" и "В", соответственно.
Если же рассматривается 1 кг смеси, в котором массовая доля компонента "А" составляет  [(кг А)/(кг см.)], то массовая доля компонента "В" в смеси равна (
[(кг А)/(кг см.)], то массовая доля компонента "В" в смеси равна ( ) [кг В/кг см.]. Очевидно
) [кг В/кг см.]. Очевидно
 . (2.5)
. (2.5)
Отсюда следует, что
 . (2.6)
. (2.6)
Подставляя сюда выражение для  из (2.3), получаем
из (2.3), получаем
 . (2.7)
. (2.7)
Проводя аналогичные рассуждения для 1 моль газовой смеси, в которой молярная доля компонента "А" равна у [(моль А)/(моль смеси)], а доля компонента "В" — (1 – у) [(моль В)/(моль смеси)], имеем:
 , (2.8)
, (2.8)
откуда
 . (2.9)
. (2.9)
Подставляя сюда выражение для Y из (2.4), получаем
 . (2.10)
. (2.10)
Фигурирующее в формулах (2.4) и (2.10) отношение  представляет собой величину, обратную молярному объёму [при нормальных физических условиях]:
представляет собой величину, обратную молярному объёму [при нормальных физических условиях]:
 . (2.11)
. (2.11)
Если считать, что молярный объём любого газа при физически нормальных условиях примерно одинаков ( м3/моль), то в таком случае из формулы (2.4) получаем
м3/моль), то в таком случае из формулы (2.4) получаем
 , (2.12)
, (2.12)
а из формулы (2.10) —
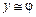 , (2.13)
, (2.13)
то есть, в отдельных случаях допустимо считать, что молярная доля компонента в газовой фазе приблизительно равна его объёмной доле.
Если для отдельных компонентов и для газовой смеси в целом применимо уравнение Клапейрона – Менделеева, то можно записать:
 (2.14)
(2.14)
и
 , (2.15)
, (2.15)
где n A – количество вещества компонента "А";
п – количество вещества смеси;
R = 8314,41 Дж/(кмоль∙К) – универсальная газовая постоянная;
р – общее давление в системе;
p A – парциальное давление компонента "А" газовой смеси.
Разделив уравнение (2.14) на (2.15) и сократив равные величины, получаем:
 . (2.16)
. (2.16)
Отношение  представляет собой молярную долю компонента в смеси; следовательно
представляет собой молярную долю компонента в смеси; следовательно
 . (2.17)
. (2.17)
В то же время в формуле (2.14) отношение  есть не что иное, как молярная концентрация компонента "А" газовой смеси.
есть не что иное, как молярная концентрация компонента "А" газовой смеси.
В результате имеем соотношение:
 . (2.18)
. (2.18)
Формулы (2.1), (2.5), (2.6), (2.8), (2.9) могут применяться не только к газовым, но и к жидким смесям, только, разумеется, с заменой в этих формулах букв "игрек" на буквы "икс".
Отношения как способ выражения состава смеси
Итак, содержание компонента в смеси может быть выражено по-разному — и через концентрации, и через доли (объёмные, массовые, молярные).
Может возникнуть вопрос: «Зачем вводить ещё какие-то “ отношения ”, когда и так существует немало различных способов выражения состава?»
Ответ был дан выше. Здесь повторим: в некоторых случаях в силу специфики массообменного процесса его анализ или расчёт удобнее всего выполнять, применяя именно отношения.
Вот простой пример.
Пусть имеются газовая фаза, состоящая из азота и аммиака, и жидкая фаза, состоящая из воды и аммиака.
Как известно, аммиак в воде растворяется очень хорошо. (Впрочем, также хорошо аммиак улетучивается из водного раствора. Каждому химику, и не только химику, знаком запах нашатырного спирта.) Азот в воде растворим чрезвычайно мало; в дальнейшем считаем, что азот совсем не растворяется в воде. Также полагаем, что молекулы Н2О не испаряются и не попадают в газовую фазу.
 Представим себе некоторый вертикальный аппарат (рис.1), в котором созданы такие условия, что может происходить поглощение аммиака жидкой фазой из газовой фазы, то есть происходить очистка азота от аммиака. (Как отмечено выше, при определённых условиях аммиак может и десорбироваться, то есть выделяться из жидкой фазы в газовую; но здесь и сейчас речь пойдёт только о предназначении одного из способов выражения содержания компонента в смеси).
Представим себе некоторый вертикальный аппарат (рис.1), в котором созданы такие условия, что может происходить поглощение аммиака жидкой фазой из газовой фазы, то есть происходить очистка азота от аммиака. (Как отмечено выше, при определённых условиях аммиак может и десорбироваться, то есть выделяться из жидкой фазы в газовую; но здесь и сейчас речь пойдёт только о предназначении одного из способов выражения содержания компонента в смеси).
В аппарат сверху непрерывно подаётся жидкий поглотитель — вода с небольшим содержанием растворённого в ней аммиака, то есть слабый (неконцентрированный) раствор. Так же непрерывно жидкая фаза отводится из аппарата снизу в виде обогащённого [аммиаком] поглотителя.
Пусть в тот же аппарат снизу непрерывно подаётся газовая смесь азота и аммиака. Пройдя через аппарат, газовая фаза отводится из аппарата сверху.
Очевидно, при условиях проведения процесса содержание NH3 в жидкой фазе увеличивается от верхнего сечения аппарата до нижнего; увеличивается и расход жидкой фазы в целом (как массовый расход, так и расход количества вещества). Содержание NH3 в газовой фазе от нижнего до верхнего сечения аппарата уменьшается; уменьшается и расход газовой фазы.
В реальных аппаратах фазы каким-то образом распределены друг в друге. Например, газовая фаза распределена в виде пузырей в жидкой фазе. Фазы отделены друг от друга (потому они и называются «фазами») хаотично изменяющейся поверхностью раздела.
Теперь представим тот же аппарат в виде условного объекта, в котором имеется фиксированная поверхность раздела фаз А‑А (рисунок 2), так что по одну сторону от неё (слева на рисунке) движется сплошная жидкая фаза, а по другую (справа на рисунке) — сплошная газовая фаза

 |
 |  |
|
|



 |




|
|


|

|
На рис. 2 ширина окрашенной фигуры в том или ином горизонтальном сечении пропорциональна расходу. На том же рисунке интенсивность окраски фигуры соответствует содержанию аммиака в фазе.
Как видно из этого рисунка, в нижнем сечении аппарата расходы обеих фаз максимальны, а в верхнем сечении — минимальны.
Далее представим, что в каждом сечении мы отсортировали молекулы NH3 от молекул Н2О в жидкой фазе, и молекулы NH3 от молекул N2 в газовой фазе (рисунок 3).
На этом рисунке молекулы NH3 имеют условную красную окраску, молекулы H2O — синюю, а молекулы N2 — жёлтую.
Из рисунка 3 видно, что как количество молекул Н2О, так и их масса в каждом сечении одинаковы, поскольку принято, что молекулы Н2О не испаряются и не попадают в газовую фазу.
Количество и масса молекул N2 так же неизменны в каждом сечении аппарата, так как принято, что азот совсем не растворяется в воде.
По этой причине в расчётах удобнее всего оперировать постоянными расходами так называемых инертных [к массообмену] носителей (в данном примере — расходами именно Н2О в жидкой фазе и N2 в газовой фазе). Очевидно, в расчётных уравнениях будут фигурировать только два параметра — два постоянных расхода носителей, вместо четырёх параметров: расходов жидкой фазы на входе в аппарат и на выходе из него и расходов газовой фазы на входе и на выходе из аппарата.
Содержание распределяемого компонента (NH3) в фазах при этом следует выражать в отношениях.
В данном примере массовые отношения аммиака в фазах  [(кг NH3)/(кг Н2О)] и
[(кг NH3)/(кг Н2О)] и  [(кг NH3)/(кг N2)], а молярные отношения этого компонента — Х [(моль NH3)/(моль Н2О)] и Y [(моль NH3)/(моль N2)].
[(кг NH3)/(кг N2)], а молярные отношения этого компонента — Х [(моль NH3)/(моль Н2О)] и Y [(моль NH3)/(моль N2)].
Материал подготовил
В. Н. Бобылёв
[1] Закон открыт нем. учёным А. Фиком (A. Fick, 1855).