Классификация аминов
Общая формула аминов R—NH2, где R — углеводородный радикал. В зависимости от природы радикала различают предельные амины (R — остаток предельного углеводорода, т. е. алкил) и ароматические амины (R — остаток ароматического углеводорода).
Гомологический ряд предельных аминов начинает простейший представитель класса — метиламин. Структурные формулы метиламина и его ближайших гомологов приведены ниже: 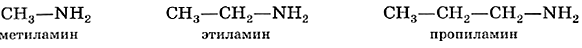
Общая формула членов данного гомологического ряда CnH2n+1NH2, или CnH2n+3N.
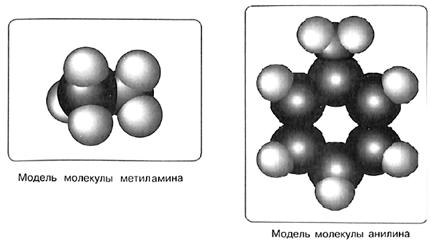
Представителем ароматических аминов является уже упомянутый нами анилин. В молекуле этого вещества аминогруппа —NH2 связана с остатком ароматического углеводорода бензола — фенильным радикалом С6Н5—. Следовательно, химическая формула анилина С6Н5—NH2: 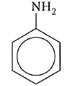
Физические свойства и получение важнейших аминов
Метиламин — бесцветное газообразное вещество с резким аммиачным запахом, хорошо растворимое в воде. Анилин представляет собой бесцветную жидкость, которая на воздухе приобретает красно-бурую окраску вследствие окисления; он также обладает резким запахом и плохо растворим в воде.
Промышленное производство метиламина основано на взаимодействии метилового спирта с аммиаком: 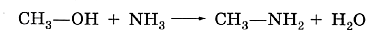
Вторым удобным способом получения аминов заданного строения служит реакция галогеналканов с избытком аммиака: 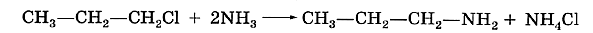
Производство анилина в промышленных масштабах связано с именем выдающегося русского учёного-химика Николая Николаевича Зинина. В 1841 г., проводя опыты с нитробензолом, он нашёл способ восстановления нитрогруппы до аминогруппы: 
Эту реакцию назвали в честь учёного — реакция Зинина. Современник Н. Н. Зинина немецкий химик Август Гофман по достоинству оценил вклад русского коллеги в развитие органической химии: «Если бы Зинин не сделал ничего более, кроме превращения нитробензола в анилин, то и тогда его имя осталось бы записанным золотыми буквами в истории химии».
Химические свойства аминов
Химические свойства аминов определяются в первую очередь наличием в их молекулах аминогруппы.
Амины рассматривают как продукты замещения в молекуле аммиака атомов водорода аминогруппами. Логично предположить, что химические свойства, характерные для аммиака, будут характерны и для его органических производных. Так оно и есть.
Аммиак характеризуется основными свойствами за счёт неподелённой электронной пары атома азота. Его водный раствор имеет щелочную реакцию, аммиак легко реагирует с кислотами с образованием солей аммония:
NH3+ НСl = NH4Cl
Амины представляют собой органические основания. Водный раствор метиламина, подобно аммиаку, изменяет окраску индикаторов, указывающих на щелочной характер среды. В растворе образуется слабый электролит — гидроксид метиламмония: 
Электролитическая диссоциация этого основания приводит к появлению в растворе гидроксид-ионов: 
Как и аммиак, амины легко образуют соли с сильными неорганическими кислотами: 
Третье положение теории строения органических соединений о взаимном влиянии атомов в молекулах подтверждается сравнением свойств рассматриваемых аминов и аммиака.
Основные свойства аминов, по сравнению с аммиаком, отражают влияние углеводородного радикала на поведение аминогруппы. Усиление основных свойств наблюдается в ряду 
Аминогруппа оказывает ответное влияние на свойства углеводородного радикала. Действительно, анилин, в отличие от бензола, легко вступает в реакцию бромирования при добавлении бромной воды, при этом никакого катализатора не требуется, а бромирование протекает не по одному, а по трём атомам углерода цикла: 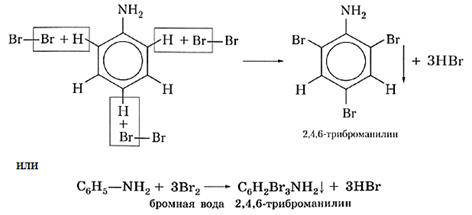
Продукт реакции — 2,4,6-триброманилин — это нерастворимое в воде вещество белого цвета, поэтому реакцию с бромной водой можно использовать для обнаружения анилина, т. е. как к ачественную реакцию на анилин.