Контрольные задания
Методические указания
Контрольные задачи составлены по стовариантной системе, в которой к каждой задаче исходные данные выбираются из соответствующих таблиц по предпоследней и последней цифрам шифра (номера зачетной книжки) студента. Вариант работы должен соответствовать шифру студента. Работы, выполненные не по своему варианту, не рассматриваются.
Тетрадь для контрольной работы должна быть подписана следующим образом:
Тетрадь
Для контрольной работы
по курсу "Техническая термодинамика"
студента группы__________
факультета_______________
Ф.И.О.___________________
Шифр___________________
Вариант №_______________
При оформлении контрольных задач необходимо соблюдать следующие условия:
1. Выписывать условие задач и исходные данные.
2. Решение задач сопровождать кратким пояснительным текстом, в котором указывать, какие величины подставляются в формулу и откуда они берутся (из условия задачи, из справочника или были определены выше и т.д.).
3. Вычисления проводить в единицах СИ, показывать ход решения.
4. В конце работы привести список использованной литературы и поставить свою подпись.
5. Для письменных замечаний рецензента оставлять чистые поля в тетради и чистые 1-2 страницы в конце работы.
6. Исправления по замечаниям рецензента должны быть записаны отдельно на чистых листах в той же тетради после заголовка "Исправления по замечаниям".
Контрольная работа №1
Задача 1. Считая теплоемкость идеального газа зависящей от температуры, определить:
а) параметры газа в начальном и конечном состояниях;
б) изменение внутренней энергии;
г) изменение энтальпии;
в) теплоту, участвующую в процессе;
г) работу расширения.
Построить график процесса в координатах р-Т, p-v, v-T.
Исходные данные, необходимые для решения задачи, выбрать из таблицы 1.
Таблица 1
| Предпоследняя цифра шифра | Процесс | t 1, °C | t 2, °C | Последняя цифра шифра | Газ | р, МПа | m, кг |
| Изохорный | О2 | ||||||
| Изобарный | N2 | ||||||
| Адиабатный | H2 | ||||||
| Изохорный | N2 | ||||||
| Изобарный | СО | ||||||
| Адиабатный | СО2 | ||||||
| Изохорный | N2 | ||||||
| Изобарный | H2 | ||||||
| Адиабатный | СО2 | ||||||
| Изобарный | СО |
Зависимость теплоемкости от температуры дана в Приложении 1.
Задача 2. Для теоретического цикла ГТУ с подводом теплоты при постоянном давлении определить параметры рабочего тела (воздуха) в характерных точках цикла, подведенную и отведенную теплоту, работу и термический КПД цикла, если начальное давление р 1 = 0,1 МПа, начальная температура t 1 = 27°С, степень повышения давления в компрессоре b, температура газа перед турбиной t 3.
Определить теоретическую мощность ГТУ при заданном расходе воздуха G. Дать схему и цикл установки в pv - и Ts -диаграммах. Данные для решения задачи выбрать из таблицы 3.
Таблица 3
| Предпоследняя цифра шифра | b= 
| Последняя цифра шифра | t 3, °С | G, кг/с | Предпоследняя цифра шифра | b= 
| Последняя цифра шифра | t 3, °С | G, кг/с |
| 6,0 | 7,5 | ||||||||
| 6,5 | 7,0 | ||||||||
| 7,0 | 6,5 | ||||||||
| 7,5 | 6,0 | ||||||||
| 8,0 | 7,0 |
Указание: Теплоемкость воздуха принять не зависящей от температуры и равной 1,005 кДж/(кг×К).
Задача 3. Пар фреона-12 при температуре t 1 поступает в компрессор, где адиабатно сжимается до давления, при котором его температура становится равной t 2, а сухость пара х 2 = 1. Из компрессора фреон поступает в конденсатор, где при постоянном давлении обращается в жидкость, после чего адиабатно расширяется в дросселе до температуры t 4 = t 1.
Определить холодильный коэффициент установки, массовый расход фреона, а также теоретическую мощность привода компрессора, если холодопроизводительность установки Q. Изобразите схему установки и ее цикл в Ts -диаграмме. Данные для решения задачи выбрать из таблицы 4.
Указание: Задачу решить с помощью таблиц параметров насыщенного пара фреона-12 (см.приложение 2).
Таблица 4
| Предпоследняя цифра шифра | t 1, °С | t 2, °С | Последняя цифра шифра | Q, кВт | Предпоследняя цифра шифра | t 1, °С | t 2, °С | Последняя цифра шифра | Q, кВт |
| -15 | -20 | ||||||||
| -10 | -15 | ||||||||
| -15 | -10 | ||||||||
| -20 | -15 | ||||||||
| -20 | -20 |
ЛИТЕРАТУРА
1. Нащекин В.В. Техническая термодинамика и теплопередача. – М.: Высш. шк., 1980. – 470 с.
2. Кириллин В.А., Сычев В.В., Шейндлин А.Е. Техническая термодинамика. – М.: Энергоиздат, 1983. – 416 с.
3. Задачник по технической термодинамике и теории тепломассообмена / под ред. В.И.Крутова и Г.П.Петражицкого. – М.: Высш. шк., 1986. - 383 с.
Приложение 1
Средние изобарные мольныетеплоемкости mс p некоторых газов
кДж/(кмоль×К)
| t 1, °C | Воздух | О2 | N2 | H2 | Водяной пар Н2О | СО | СО2 |
| 29,073 | 29,274 | 29,115 | 28,617 | 33,499 | 29,123 | 35,860 | |
| 29,153 | 29,538 | 29,144 | 29,935 | 33,741 | 29,178 | 38,112 | |
| 29,299 | 29,931 | 29,228 | 29,073 | 34,188 | 29,303 | 40,059 | |
| 29,521 | 30,400 | 29,383 | 29,123 | 34,575 | 29,517 | 41,755 | |
| 29,789 | 30,878 | 29,601 | 29,186 | 35,090 | 29,789 | 43,250 | |
| 30,095 | 31,334 | 29,864 | 29,249 | 35,630 | 30,099 | 44,573 | |
| 30,405 | 31,761 | 30,149 | 29,316 | 36,195 | 30,426 | 45,758 | |
| 30,723 | 32,150 | 30,451 | 29,408 | 36,789 | 30,752 | 46,813 | |
| 31,028 | 32,502 | 30,748 | 29,517 | 37,392 | 31,070 | 47,763 | |
| 31,321 | 32,825 | 31,037 | 29,647 | 38,008 | 31,376 | 48,617 | |
| 31,598 | 33,118 | 31,313 | 29,789 | 38,619 | 31,665 | 49,392 | |
| 32,109 | 33,633 | 31,828 | 30,107 | 39,825 | 32,192 | 50,740 | |
| 32,565 | 34,076 | 32,293 | 30,467 | 40,976 | 32,653 | 51,858 | |
| 32,967 | 34,474 | 32,699 | 30,832 | 42,056 | 33,051 | 52,800 | |
| 33,319 | 34,834 | 33,055 | 31,192 | 43,070 | 33,402 | 53,604 | |
| 33,641 | 35,169 | 33,373 | 31,548 | 43,995 | 33,708 | 54,290 | |
| 33,296 | 35,483 | 33,658 | 31,891 | 44,853 | 33,980 | 54,881 | |
| 34,185 | 35,785 | 33,909 | 32,222 | 45,645 | 34,223 | 55,391 |
Приложение 2
Насыщенный пар фреона-12 (CCl2F2)
| t, °C | P, МПа | v ¢, дм3/кг | v ¢¢, м3/кг | h ¢ | h ¢¢ | r | s ¢ | s ¢¢ |
| кДж/кг | кДж/(кг×К) | |||||||
| -20 | 0,1510 | 0,6868 | 0,11070 | 400,5 | 564,0 | 163,5 | 4,1183 | 4,7645 |
| -15 | 0,1826 | 0,6940 | 0,09268 | 405,0 | 566,4 | 161,4 | 4,1356 | 4,7613 |
| -10 | 0,2191 | 0,7018 | 0,07813 | 409,5 | 568,9 | 159,4 | 4,1528 | 4,7586 |
| -5 | 0,2609 | 0,7092 | 0,06635 | 414,0 | 571,2 | 157,2 | 4,1698 | 4,7561 |
| 0,3086 | 0,7173 | 0,05667 | 418,7 | 573,6 | 154,9 | 4,1868 | 4,7539 | |
| 0,3624 | 0,7257 | 0,04863 | 423,4 | 575,9 | 152,4 | 4,2036 | 4,7519 | |
| 0,4230 | 0,7342 | 0,04204 | 428,1 | 578,1 | 150,0 | 4,2204 | 4,7501 | |
| 0,4911 | 0,7435 | 0,03648 | 433,0 | 580,3 | 147,3 | 4,2371 | 4,7484 | |
| 0,5667 | 0,7524 | 0,03175 | 437,9 | 582,5 | 144,6 | 4,2537 | 4,7469 | |
| 0,6508 | 0,7628 | 0,02773 | 442,8 | 584,5 | 141,7 | 4,2702 | 4,7455 | |
| 0,7434 | 0,7734 | 0,02433 | 447,9 | 586,5 | 138,6 | 4,2868 | 4,7441 | |
| 0,8460 | 0,7849 | 0,02136 | 452,9 | 988,3 | 135,4 | 4,3031 | 4,7425 | |
| 0,9582 | 0,7668 | 0,01882 | 451,1 | 590,1 | 132,0 | 4,3194 | 4,7410 |
См. далее примеры решения задач!!!
Примеры решения задач
Задача 1. Считая теплоемкость идеального газа зависящей от температуры, определить: параметры газа в начальном и конечном состояниях, изменение внутренней энергии, теплоту, участвующую в процессе, и работу расширения, если процесс изобарный, рабочее тело – кислород, t 1 = 1500°C, t 2 = 100°C, р 1 =12 МПа, m = 7 кг. Построить графики процесса в координатах в координатах p-v, p-Т и v-Т.
Решение.
1. Изобарный процесс – это процесс, протекающий при постоянном давлении, уравнение процесса р = const.
Параметры газа в начальном и конечном состояниях:
Т 1 = 1500 + 273 = 1773 К;
Т 2 = 100 + 273 = 373 К;
p 1 = p 2 =12×106 Па;
Из уравнения состояния, записанного для начального и конечного состояний системы, определим v 1 и v 2:
p 1 v 1 = RT 1,
p 2 v 2 = RT 2,
где R – удельная газовая постоянная.
Для кислорода  Дж/кг×К.
Дж/кг×К.
Так как p 1 = p 2, то  .
.
Тогда  м3/кг.
м3/кг.
 м3/кг.
м3/кг.
2. Изменение внутренней энергии в изобарном процессе:
 , где
, где 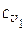 и
и 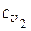 - удельные теплоемкости газа при постоянном объеме при температурах Т 1 и Т 2 соответственно.
- удельные теплоемкости газа при постоянном объеме при температурах Т 1 и Т 2 соответственно.
В приложении 1 даны значения удельной молярной теплоемкости m  в зависимости от температуры. Удельные теплоемкости газа при постоянном объеме
в зависимости от температуры. Удельные теплоемкости газа при постоянном объеме 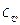 и постоянном давлении
и постоянном давлении  связаны уравнением
связаны уравнением 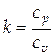 , где
, где  . Тогда
. Тогда  .
.
Для двухатомных газов (например, кислород О2) k =1,4. Определяя по таблице в приложении 1 значения m  для температур Т 1 и Т 2, вычислим:
для температур Т 1 и Т 2, вычислим:
 кДж/кг×К;
кДж/кг×К;  кДж/кг×К;
кДж/кг×К;
 кДж/кг×К;
кДж/кг×К;  кДж/кг×К.
кДж/кг×К.
Тогда D u = 0,65×373 – 0,72×1773 = -1034,11 кДж/кг.
3. Изменение энтальпии
 кДж/кг.
кДж/кг.
4. Теплота, участвующая в процессе,
 кДж/кг.
кДж/кг.
Q = q×m = -1451,3 × 7 = -10159,1 кДж.
5. Изменение энтропии
 кДж/кг×К.
кДж/кг×К.
6. Работа расширения
l = p (v 2 – v 1) = 12×106(0,008-0,038)=-360000 Дж/кг = -0,36 МДж/кг.
L = l×m = -0,36×7 = 2,52 МДж.
 7. График процесса
7. График процесса
- в координатах pv: - в координатах pТ: - в координатах vТ:
Задача 2. Исходные параметры воздуха, поступающего в компрессор ГТУ с сжиганием топлива при р = const, р 1 = 0,1 МПа, t 1 = 20°С. Степень повышения давления в компрессоре ГТУ b = 6. Температура газов перед турбиной t 3 = 700°С. Расход воздуха через компрессор G = 2×105 кг/ч.
Определить:
- параметры всех точек идеального цикла ГТУ;
- теоретические мощности турбины, компрессора и всей ГТУ;
- параметры всех точек реального цикла (с учетом необратимости процессов расширения и сжатия в турбине и компрессоре), принимая внутренние относительные КПД турбины и компрессора соответственно 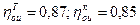 ;
;
- внутренний КПД ГТУ, реальные мощности турбины, компрессора и всей ГТУ.
Представить оба цикла в Тs -диаграмме. Теплоемкость воздуха принять независимой от температуры и равной ср = 1,005 кДж/кг×К.
По справочнику для воздуха k = 1,4.
Решение. Изобразим идеальный и реальный циклы ГТУ с изобарным подводом тепла и адиабатным сжатием воздуха в компрессоре в Тs -координатах.

1-2 – адиабатное сжатие воздуха в компрессоре;
2-3 – изобарный подвод тепла (горение топлива);
3-4 – адиабатное расширение продуктов сгорания в соплах
турбины;
4-1 – изобарный отвод тепла (выход продуктов сгорания в
атмосферу).
1-2-3-4-1 – обратимый цикл ГТУ (идеальный);
1-5-3-6-1 – необратимый цикл (реальный).
Температура в точках обратимого цикла:
1. Т 1 = 20 + 273 = 293 К.
2. Так как процесс 1-2 адиабатный, то
 ).
).
3. Т3 = 700 + 273 = 973 К.
4. Так как  , то
, то  .
.
В данном цикле тепло подводится в изобарном процессе 2-3. Тогда
q 1 = c p(T 3 – T 2) = 1,005(973-489) = 486,42 кДж/кг.
Тепло отводится в изобарном процессе 4-1:
q 2 = c p(T 4 – T 1) = 1,005(583-293) = 291,45 кДж/кг.
Работа цикла
l ц = q 1 - q 2 = 486,42 - 291,45 = 194,97 кДж/кг.
Термический КПД цикла в общем случае:
 .
.
Теоретические мощности:
- турбины
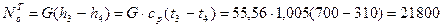 кВт.
кВт.
- компрессора
 кВт.
кВт.
- ГТУ в целом
 кВт.
кВт.
Температура в точках 5, 6 реального цикла рассчитываются таким образом. Из основной формулы для внутреннего относительного КПД компрессора:

найдем температуру в конце сжатия t 5:
 .
.
Для нахождения температуры в конце необратимого адиабатного расширения воспользуемся выражением для внутреннего относительного КПД турбины:
 .
.
Тогда  .
.
Внутренний КПД ГТУ:
 .
.
Истинная мощность турбины
 кВт.
кВт.
Истинная мощность привода компрессора
 кВт.
кВт.
или 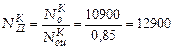 кВт.
кВт.
Истинная мощность ГТУ
 кВт.
кВт.
Вывод: приведеный расчет показывает, что истинная мощность ГТУ меньше теоретической в 1,8 раза вследствие необратимых процессов сжатия и расширения рабочего тела.
Задача 3. Пар фреона-12 при температуре t 1 = -20°C поступает в компрессор, где изоэнтропно сжимается до давления, при котором его температура становится равной t 2 = 25°C, а сухость пара х 2 = 1. Из компрессора фреон поступает в конденсатор, где при постоянном давлении обращается в жидкость, после чего адиабатно расширяется в дросселе (т.е. при h = const) до температуры t 4 = t 1.
Определить: холодильный коэффициент установки; массовый расход фреона; теоретическую мощность привода компрессора, если холодопроизводительность установки Q = 150 кВт. Изобразите схему установки и ее цикл в.
Решение. Удельная холодопроизводительность
q 2 = r 1×(x 1 – x 2), кДж/кг,
где r 1 – теплота парообразования при t 1 (при t 1 = -20°C из Приложения 2 найдем, что r 1 = 163,5 кДж/кг);
x 1, x 2 – степень сухости пара перед компрессором и после дроссельного вентиля соответственно.
Степень сухости x 1 пара определим по уравнению:
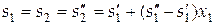 ,
,
где из приложения 2:
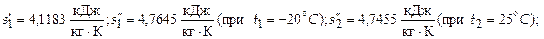
Следовательно  .
.
Степень сухости после дроссельного вентиля определяем по уравнению:
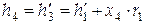 ,
,
где 
 .
.
Тогда  .
.
Удельная холодопроизводительность  .
.
Теплота, отведенная от рабочего тела в конденсаторе  ,
,
где  .
.
Тогда 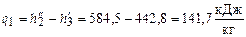 .
.
Работа, затраченная в цикле, l ц = q 1 – q 2 = 141,7 – 116,4 = 25,3 кДж/кг.
Холодильный коэффициент  .
.
Массовый расход фреона  .
.
Теоретическая мощность привода компрессора  .
.
 Схема установки:
Схема установки:
1 – дроссельный вентиль, 2- испаритель, 3 – компрессор, 4 – конденсатор.
 Цикл в Т-s -координатах:
Цикл в Т-s -координатах:
ТЕОРИЯ ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ (!!!) + то, что есть в задачах
Основные термодинамические процессы идеального газа
Задачей исследования термодинамических процессов является нахождение следующих зависимостей и величин, характеризующих эти процессы:
1) уравнений, описывающих процесс в системах координат p - v, т.е. уравнений f (v, p) = 0, s-T, т.е. уравнений f 1(s, p) = 0;
2) аналитической взаимосвязи между отдельными параметрами, характерной для рассматриваемого процесса, т.е. связи между параметрами p, v, T и s: p = f 1(v), T = f 2(v), T = f 3(p), s = f 4(T);
3) величины работы изменения объема рабочего тела;
4) величины изменения внутренней энергии;
5) величины работы изменения энтальпии рабочего тела;
6) величины работы изменения энтропии рабочего тела;
7) количества тепла, подведенного за время процесса к рабочему телу или отведенного от него;
8) величину теплоемкости рабочего тела.
В технической термодинамике изучаются следующие основные термодинамические процессы: изохорный, изобарный, изотермический, адиабатный и политропный.
Охарактеризуем по приведенной выше схеме каждый из перечисленных термодинамических процессов.
Изохорный процесс
Процесс, протекающий при постоянном объеме, называется изохорным. Кривая процесса называется изохорой.
1) Уравнение процесса v = const;
2) Связь параметров p 1 v 1 = RT 1
р 2 v 2 = RT 2


3) График процесса в координатах p - v (рис.5):
процесс 1-2 – подвод тепла; процесс 2-1 – отвод тепла.
Внешняя работа газа при v = const равна нулю, так как d v = 0.
Следовательно  .
.
4) Изменение внутренней энергии из D u = с v (Т2 – Т1).
5) Изменение энтальпии D h =с p (Т2 – Т1).
6) Изменение энтропии  ;
;
 .
.
7) Количество теплоты d q = d u + d l.
Так как d l = 0, d q = d u; q = D u.
Изобарный процесс
Процесс, протекающий при постоянном давлении, называют изобарным. Кривая процесса называется изобарой.
1) Уравнение процесса р = const;
2)  Связь параметров p 1 v 1 = RT 1
Связь параметров p 1 v 1 = RT 1
р 2 v 2 = RT 2
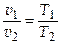 .
.
3) График процесса в координатах p - v (рис.7):
процесс 1-2 – подвод тепла;
процесс 2-1 – отвод тепла.
Удельная работа газа при р = const выражается следующим уравнением 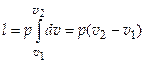
4) Изменение внутренней энергии D u = с v (Т2 – Т1).
5) Изменение энтальпии D h =с p (Т2 – Т1).
6) Изменение энтропии  ;
;
 .
.
7) Количество теплоты d q = d h – v d p. Так как d p = 0, d q = d h; q = D h.
Изотермический процесс
Процесс, протекающий при постоянной температуре, называют изотермическим (Т = const, d Т = 0). Кривая процесса называется изотермой.
1) Уравнение процесса Т = const; (p v = const)
2) Связь параметров p 1 v 1 = RT 1
р 2 v 2 = RT 2

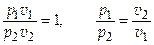 (закон Бойля-Мариотта).
(закон Бойля-Мариотта).
3) график процесса в координатах p - v (рис.9): процесс 1-2 – подвод тепла; процесс 2-1 – отвод тепла.
Удельная работа газа при Т = const выражается следующим уравнением  ,
,
Но из уравнения изотермы имеем pv = p 1 v 1, или  , поэтому
, поэтому
 .
.
4) изменение внутренней энергии D u =0.
5) изменение энтальпии D h =0.
6) количество теплоты d q = d h + d l. q = l. Так как d p = 0, d q = d h; q = D h.
7) Изменение энтропии:  .
.
Адиабатный процесс
Процесс, протекающий без подвода и отвода теплоты, т.е. при отсутствии теплообмена рабочего тела с окружающей средой, называют адиабатным, кривая этого процесса называется адиабатой.
 1) Уравнение процесса
1) Уравнение процесса 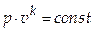 .
.
2) Связь параметров:



3) Адиабата в координатах pv (рис.11)идет круче изотермы, так как k >1.
4) изменение внутренней энергии  .
.
5) изменение энтальпии  .
.
6) Для обратимого адиабатного процесса количество теплоты d q = d u + d l = 0.
Работа совершается за счет убыли внутренней энергии: d l = - d u.
d l = - d u = - сv (T 2 – T 1) = сv (T 1 – T 2)
 .
.
7) изменение энтропии 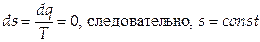 .
.