ЛС производные бензопирана
α- и γ-Пиран способны образовывать конденсированные системы с ядром бензола, например 1,2-бензопиран и 1,4-бензопиран:
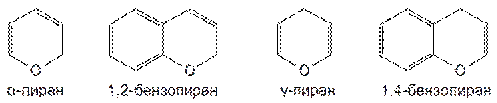
Конденсированные производные бензола и α-пирона и γ-пирона, содержащие кетонные группы, называют соответственно кумарин и γ-хромон.
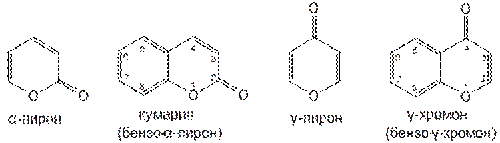
Тетрагидропиран (гидрированный γ-пиран) образует с бензолом продукт конденсации — хроман (бензо-γ-дигидропиран):

Хроман лежит в основе структуры флавана и флавона, являющихся структурной основой флавоноидов:
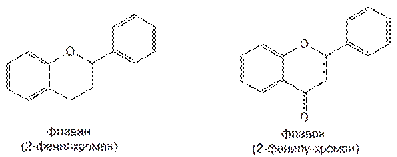
Бензопиран является структурной основой целого ряда лекарственных веществ, как синтетических, так и природного происхождения. Некоторые из них сходны по химической структуре и фармакологическому действию и могут быть классифицированы на следующие группы:
1. Кумарины и их производные, представляют собой синтетические аналоги природных веществ. К их числу можно отнести антикоагулянты, производные 4-оксикумарина. Структурным аналогом кумаринов является производное индандиона-1,3, антикоагулянт непрямого действия — фениндион.
2. Производные бензо-γ-пирона оказались эффективными лекарственными средствами для профилактики приступов бронхиальной астмы. Их действие основано на торможении высвобождения из «тучных» клеток гистамина.
3. Производные хромана (бензо-γ-дигидропирана). Группа природных веществ, обладающих E-витаминной активностью (токоферолов).
4. Производные флавана (2-фенилхромана). Большая группа природных веществ-флавоноидов, обладающих Р-витаминной активностью.
Производные 4-оксикумарина
Идея создания антикоагулянтов возникла после того, как в 1940 г было установлено возникновение кровотечения у животных, поедающих клевер, содержащий производные кумарина. Одно из них — дикумарин образуется в клеверном соке в результате биосинтеза из 4-оксикумарина и формальдегида.
|
|
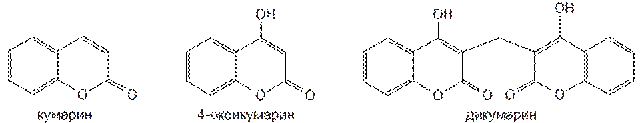
Дикумарин был синтезирован и длительное время применялся в качестве антикоагулянта. Однако он вызывал длительные кровотечения, поражения печени, другие побочные явления. В результате проведённых широких исследований были созданы более эффективные и менее токсичные антикоагулянты, производные 4-оксикумарина и его структурных аналогов. Синтетические производные 4-оксикумарина содержат в молекуле одну (I) или две (II) гетероциклические системы кумарина с оксигруппой в положении 4. При наличии двух остатков 4-оксикумарина они связаны между собой метиленовой группой:
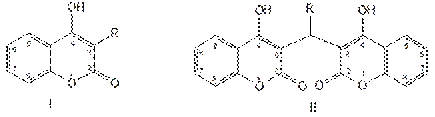
К производным (I) относится фепромарон и аценокумарол (синкумар), а ко (II) — этилбискумацетат (неодикумарин).
Источником синтеза фепромарона и аценокумарола служит 4-оксикумарин, который конденсируют с соответствующим кетоном. Схема синтеза аценокумарола:
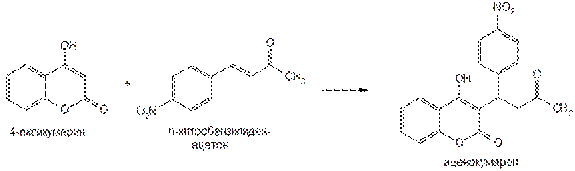
Фепромарон синтезируют из 4-оксикумарина и стирилэтилкетона по той же схеме.
Исходным продуктом синтеза этилбискумацетата является 4-оксикумарин и этиловый эфир глиоксалевой кислоты. Его получают из щавелевой кислоты:
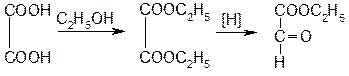
Затем сочетают с двумя молекулами 4-оксикумарина:
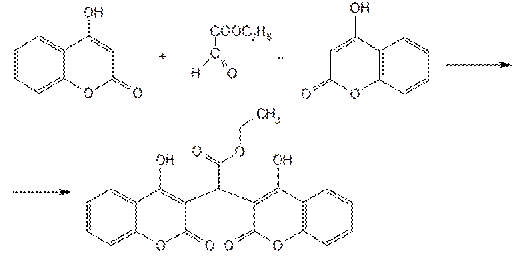
Этилбискумацетат, фепромарон и аценокумарол — белые или с кремовым оттенком кристаллические вещества.
Свойства производных 4-оксикумарина
| Лекарственное вещество | Химическая структура | Описание |
| Ethyl Biscoumacetate— этилбискумацетат (Неодикумарин) | 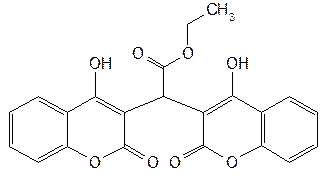 этиловый эфир ди-(4-оксикумарил-3)-уксусной кислоты этиловый эфир ди-(4-оксикумарил-3)-уксусной кислоты
| Белый или белый со слегка кремоватым оттенком мелкокристаллический порошок без запаха. Т.пл. 175–178°C или 151–154°C |
| Phepromaron— фепромарон | 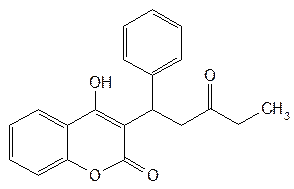 3-(a-фенил-b-пропионилэтил)-4-оксикумарин 3-(a-фенил-b-пропионилэтил)-4-оксикумарин
| Белый или белый со слегка кремоватым оттенком кристаллический порошок без запаха. Т.пл. 149–151°C |
| Acenocoumarol— аценокумарол (Синкумар) | 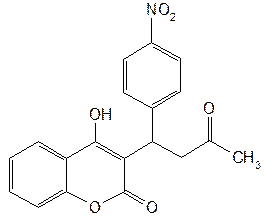 3-[a-(4-нитрофенил)-b-ацетилэтил]-4-оксикумарин 3-[a-(4-нитрофенил)-b-ацетилэтил]-4-оксикумарин
| Белый или белый с кремоватым оттенком кристаллический порошок без запаха. Т.пл. 191–192°C |
Этилбискумацетат может образовывать несколько полиморфных модификаций, которые различаются по температуре плавления. Это доказано с помощью методов ИК-спектроскопии, термомикроскопии, дериватографии, дифракции рентгеновских лучей. Производные 4-оксикумарина очень мало (этилбискумацетат) или практически нерастворимы (аценокумарол и фепромарон) в воде, мало растворимы или растворимы в этаноле, растворимы в растворах гидроксидов щелочных металлов (поскольку являются фенолами). В ацетоне этилбискумацетат умеренно растворим, а фепромарон — растворим.
|
|
Подлинность производных 4-оксикумарина можно установить по ИК-спектрам, а также с помощью УФ-спектрофотометрии. Раствор этилбискумацетата в этаноле имеет два максимума поглощения (276 и 303 нм), а фепромарона — один при 313 нм. В 0,1 М растворе гидроксида натрия они оба имеют по одному максимуму; этилбискумацетат — при 310 нм, а фепромарон — при 307 нм.
Испытание на подлинность этилбискумацетата, фепромарона и аценокумарола основано на использовании химических свойств, обусловленных наличием в их молекулах тех или иных функциональных групп (фенольного гидроксила, лактонного цикла, этоксильной, кетонной, нитрогрупп).
|
|
При сплавлении этилбискумацетата или фепромарона со щелочью происходит разрыв лактонного цикла с образованием салицилат-иона. Его можно обнаружить по выпадению осадка салициловой кислоты после подкисления фильтрата хлороводородной кислотой или цветной реакцией с хлоридом железа (III) (сине-фиолетовое окрашивание):
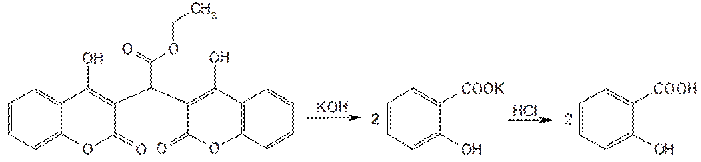
Подлинность этилбискумацетата и других производных кумарина устанавливают с помощью реакции азосочетания, которую выполняют после предварительного нагревания на водяной бане (3–5 мин) с 0,1 М раствором гидроксида натрия. В этих менее жестких условиях происходит разрыв лактонного цикла:
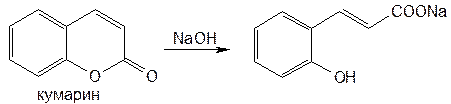
Образовавшийся фенол сочетают с диазотированной сульфаниловой кислотой или другим ароматическим амином. Появляется ярко-оранжевое или вишнево-красное окрашивание (азокраситель).
С концентрированной серной кислотой при слабом нагревании этилбискумацетат дает желтое, а затем оранжевое окрашивание. Разбавление окрашенного продукта водой приводит к образованию белого осадка, который представляет собой ди-(4-оксикумаринил-3)-уксусную кислоту (продукт гидролиза этилбискумацетата):
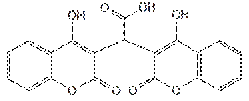
Полученная кислота образует растворимые соли. При добавлении раствора аммиака осадок растворяется, образуя бесцветный раствор, а после добавления гидроксида натрия получается раствор соломенно-желтого цвета.
Присутствие остатка этилового эфира в молекуле этилбискумацетата подтверждают реакцией с раствором иода и гидроксида натрия, в результате которой образуется иодоформ, имеющий характерный запах. Этилбискумацетат дает в спиртовом растворе при нагревании цветную реакцию с хлоридом железа (III) (красно-бурое окрашивание).
Для идентификации и количественного определения этилбискумацетата и фепромарона используют способность входящих в молекулу фенольных гидроксилов к этерификации. Ацетилирование этилбискумацетата уксусным ангидридом (нагревание с обратным холодильником) проводят в течение 1 ч, затем реакционную смесь выливают в воду и оставляют на 30 мин. Образуется осадок диацетата этилбискумацетата:
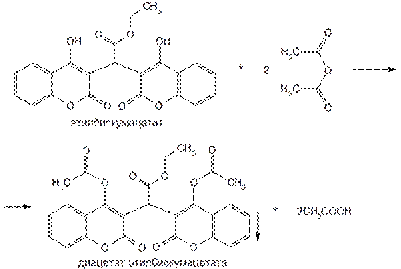
Подлинность этилбискумацетата подтверждают также по температуре плавления перекристаллизованного и высушенного диацетата.
Количественное определение можно выполнить гравиметрическим методом или титруя избыток несвязавшегося при ацетилировании уксусного ангидрида.
Фепромарон ввиду наличия в молекуле фенольного гидроксила при действии уксусным ангидридом образует моноацетильное производное, температура плавления которого (после очистки и перекристаллизации) равна 109–110 °C.
Фенольный характер гидроксила фепромарона можно подтвердить также с помощью реакции образования азокрасителя. Растворяют фепромарон в растворе гидроксида натрия, охлаждают до –5 °C и вливают в диазореактив, содержащий сульфаниловую кислоту, хлороводородную кислоту и нитрит натрия. Через 4–5 мин появляется желтое окрашивание, переходящее через 30–40 мин в ярко-оранжевое:
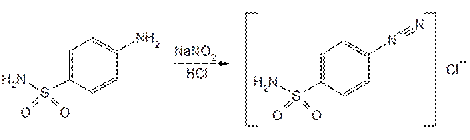
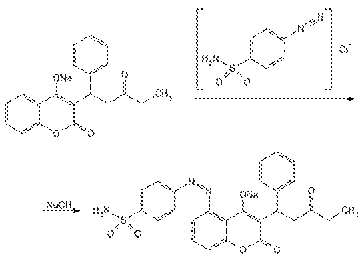
Реакцию образования азокрасителя используют для обнаружения нитрогруппы в ароматическом кольце молекулы аценокумарола после предварительного гидрирования ее до аминогруппы (действием цинковой пыли в присутствии хлороводородной кислоты). Затем действуют раствором нитрита натрия, мочевиной и через 1-2 мин прибавляют щелочной раствор b-нафтола; появляется красное окрашивание. Реакция происходит по общей схеме:
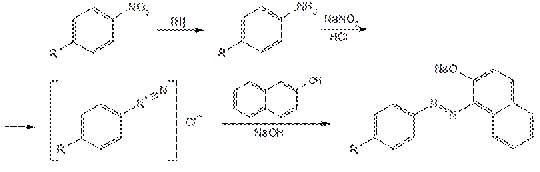
Мочевину прибавляют для удаления избытка нитрита натрия:
Для подтверждения наличия в фепромароне и аценокумароле алифатической кетонной группы смешивают 0,5 г лекарственного вещества, 4 мл воды и 0,4 мл салицилового альдегида. Затем прибавляют 2 мл концентрированной серной кислоты и нагревают в течение 15 мин на водяной бане. Слой салицилового альдегида приобретает оранжевое окрашивание.
При испытании на чистоту устанавливают наличие продуктов синтеза или гидролиза. В фепромароне определяют примесь 4-оксикумарина (не более 0,5%) титрованием 0,1 М раствором гидроксида натрия (индикатор фенолфталеин) после извлечения кипящей водой. В этилбискумацетате методом ТСХ определяют примесь ди-(4-оксикумаринил-3)-уксусной кислоты.
Количественное определение этилбискумацетата основано на кислотных свойствах его растворов в органических растворителях, обусловленных наличием в молекуле двух гидроксильных групп. Определение проводят методом нейтрализации, титруя 0,1 М раствором гидроксида натрия. Растворителем служит ацетон. При титровании используют смешанный индикатор (смесь метилового красного и метиленового синего). Происходит образование монозамещенной соли (енолята):
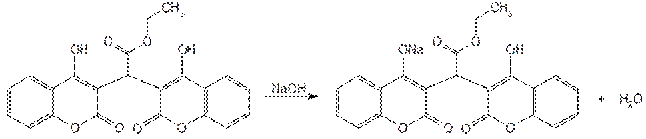
Аналогичную методику используют для определения аценокумарола и фепромарона, но в качестве индикатора применяют фенолфталеин. Навеску фепромарона предварительно растворяют в нейтрализованном ацетоне при осторожном нагревании на водяной бане, а затем титруют 0,1 М раствором гидроксида натрия:
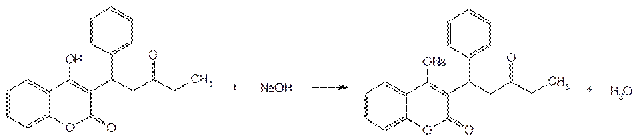
Этилбискумацетат, фепромарон и аценокумарол хранят по списку А в хорошо укупоренной таре, предохраняющей от действия света и влаги. Аценокумарол хранят при температуре не выше 30 °C и относительной влажности до 70%.
Применяют производные 4-оксикумарина в качестве антикоагулянтов непрямого действия (антивитаминов группы К). Назначают для профилактики и лечения тромбозов этилбискумацетат по 0,2 г в первый день, по 0,15 г 3 раза во второй день, затем по 0,2–0,1 г в сутки. Фепромарон оказывает более длительное действие. Назначают его вначале по 0,03–0,05 г, затем дают поддерживающие дозы 0,01–0,005 г. Аценокумарол выпускают в таблетках по 0,004 г.
Производные индана
Сходным по химической структуре и фармакологической активности с антикоагулянтами-производными кумарина является фениндион, производное индана:
Фениндион впервые был синтезирован в Институте органического синтеза АН Латвии.
Оптимальным является способ его синтеза по схеме:
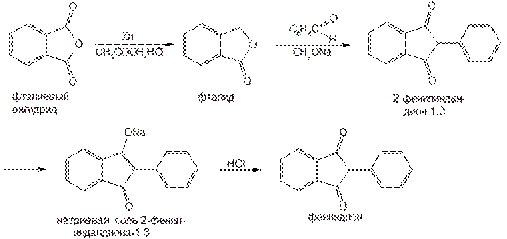
Свойства фениндиона
| Лекарственное вещество | Химическая структура | Описание |
| Phenindione— фениндион (Фенилин) |  2-фенилиндандион-1,3 2-фенилиндандион-1,3
| Кремовато-белые кристаллы, почти без запаха. Т.пл. 148–151 °C |
Фениндион— кремовато-белое кристаллическое вещество, очень мало растворимое в воде, растворы имеют окраску от оранжевой до оранжево-красной. Легко растворим в хлороформе и бензоле, мало растворим в этаноле и эфире. Раствор в эфире имеет ярко-жёлтый цвет.
Раствор фениндиона в этаноле имеет в УФ-области максимум поглощения при 269 нм, а в 0,1 М растворе гидроксида натрия — максимумы в области 280 и 328 нм.
Подлинность фениндиона можно также установить химическими (цветными) реакциями. При смешивании с раствором гидроксида натрия появляется красный осадок, который после прибавления воды образует красного цвета раствор. Это происходит вследствие таутомерии и удлинения цепи сопряженных связей.
При нагревании смеси фениндиона с раствором ацетата аммония в ледяной уксусной кислоте образуется раствор красного цвета, из которого при охлаждении и разбавлении водой выпадает красный осадок. При действии на кристаллы фениндиона концентрированной серной кислотой появляется фиолетово-синее окрашивание; последующее разбавление водой приводит к исчезновению окраски и выпадению белого осадка.
Чистота. Посторонние примеси (не более 2%) определяют методом ТСХ на пластинках Силикагель 60 восходящим методом в смеси хлороформ-метанол-ледяная уксусная кислота (90:10:1) и просматривают в УФ-свете. Сумма пятен по величине и интенсивности — не более пятна свидетеля.
Количественное определение основано на использовании кислотных свойств растворов фениндиона в этаноле. Титруют 0,1 М раствором гидроксида натрия с потенциометрическим установлением точки эквивалентности.
Определить содержание фениндиона можно с использованием реакции бромирования (10%-ным спиртовым раствором брома).
Затем (через 5 мин) добавляют b-нафтол и раствор иодида калия. Избыток свободного брома связывают b-нафтолом.
Бромпроизводное фениндиона взаимодействует с иодидом калия.
Выделившийся иод титруют 0,1М раствором тиосульфата натрия (индикатор крахмал):
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Хранят фениндион по списку A в хорошо укупоренной таре, предохраняя от действия света.
Фениндион — антикоагулянт непрямого действия. Его применяют при тех же показаниях, что и этилбискумацетат, внутрь для профилактики и лечения тромбозов и тромбоэмболий. Выпускают в таблетках по 0,03 г.