· Дисперсные системы и их виды
· Суспензии
· Эмульсии
· Коллоидные растворы
· Истинные растворы
· Растворы и их концентрация
Дисперсные системы – образования, состоящие из двух или более фаз, которые практически не смешиваются и не реагируют друг с другом. Вещество, которое мелко распределено в другом веществе (дисперсионная среда) называют дисперсной фазой.
Различают гомогенные и гетерогенные дисперсные системы. Гомогенные системы по-другому называют истинными растворами.
Самый простой состав – это растворитель и растворенное вещество. Растворитель представляет собой вещество, которое при растворении не меняет свое состояние. В большинстве случаев растворителем служит вода, однако это могут быть и неводные растворители (этанол, гексан, хлороформ). Если смешиваются вещества в одинаковом агрегатном состоянии, к примеру, жидкость с жидкостью или газ с газом, растворителем будет компонент, которого больше. Образование раствора зависит от характера взаимодействия между частицами растворителя и растворенного вещества, их природой.
Существует классификация дисперсных систем по размеру частиц дисперсной фазы.
Выделяют:
· молекулярно-ионные (< 1 нм), состоящие из молекул или ионов растворенного вещества, их следует рассматривать как однофазную систему (глюкоза, сахароза) - растворы
· коллоидные (1-100 нм) - золи - коллоиды занимают промежуточное положение между грубодисперсными системами и истинными растворами.
· грубодисперсные (>100 нм) системы - эмульсии (масло) и суспензии (раствор глины)
Абсолютно нерастворимых веществ - не существует! Максимальное количество растворяемого вещества, которое может раствориться в определённом количестве растворителя при данной температуре, называется растворимостью. В случае, если растворённое вещество уже не может больше растворяться в растворителе (при данной температуре), то такой раствор называется насыщенным. Определить, сколько вещества растворяется при определённой температуре в растворителе, можно по специальным графиками растворимости.
Суспензии — это дисперсные системы, в которых дисперсной фазой является твердое вещество, а дисперсионной средой — жидкость, причем твердое вещество практически нерастворимо в жидкости.
Эмульсии — это дисперсные системы, в которых и дисперсная фаза и дисперсионная среда являются жидкостями, взаимно не смешивающимися. Примером эмульсии является молоко, в котором мелкие шарики жира плавают в жидкости.
Суспензии и эмульсии — двухфазные системы.
Коллоидные растворы — это высокодисперсные двухфазные системы, состоящие из дисперсионной среды и дисперсной фазы, причем линейные размеры частиц последней лежат в пределах от 1 до 100 нм. Как видно, коллоидные растворы по размерам частиц являются промежуточными между истинными растворами и суспензиями и эмульсиями. Коллоидные частицы обычно состоят из большого числа молекул или ионов.
В состав любого живого организма входят твердые, жидкие и газообразные вещества, находящиеся в сложнейших взаимоотношениях друг с другом и окружающей средой. Цитоплазма клеток обладает свойствами, характерными как для жидких, так и студнеобразных веществ. С химической точки зрения организм в целом - это сложная совокупность многих коллоидных систем, включающих в себя и жидкие коллоиды, и гели.
Если частицы дисперсной фазы достаточно малы, коллоидная система напоминает истинный раствор, отсюда и происходит название - коллоидный раствор. Такая систем образуется, например, при растворении небольшого количества яичного белка в воде.
Коллоидные растворы иначе называют золями. Их получают дисперсионными и кондесационными методами. Диспергирование чаще всего производят при помощи особых «коллоидных мельниц». При конденсационном методе коллоидные частицы образуются за счет объединения атомов или молекул в агрегаты. При протекании многих химических реакций происходит конденсация и образуются высокодисперсные системы (выпадение осадков, протекание гидролиза, окислительно-восстановительные реакции и т.д.).
1 нм — нанометр (1 нм = 10-9 м).
В отличие от истинных растворов для золей характерен эффект Тиндаля, т. е. рассеяние света коллоидными частицами. При пропускании через золь пучка света появляется светлый конус, видимый в затемненном помещении 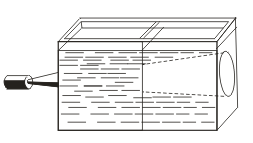 . Так можно распознать, является данный раствор коллоидным или истинным.
. Так можно распознать, является данный раствор коллоидным или истинным.
Одним из важных свойств золей является то, что их частицы имеют электрические заряды одного знака. Благодаря этому они не соединяются в более крупные частицы и не осаждаются. При этом частицы одних золей, например металлов, сульфидов, кремниевой и оловянной кислот, имеют отрицательный заряд, других, например гидроксидов, оксидов металлов, — положительный заряд. Возникновение заряда объясняется адсорбцией коллоидными частицами ионов из раствора.
Коллоиды могут быть произведены человеком (например, крахмалы, декстраны или желатины), или иметь естественное происхождение (например, альбумин или свежезамороженная плазма (СЗП)), и они содержат большие молекулы, позволяющие дольше оставаться в крови перед попаданием в другие части организма.
Для осаждения золя необходимо, чтобы его частицы соединились в более крупные агрегаты.
Соединение частиц в более крупные агрегаты называется коагуляцией, а осаждение их под влиянием силы тяжести — седиментацией.
Обычно коагуляция происходит при прибавлении к золю:
1) электролита,
2) другого золя, частицы которого имеют противоположный заряд,
3) при нагревании.