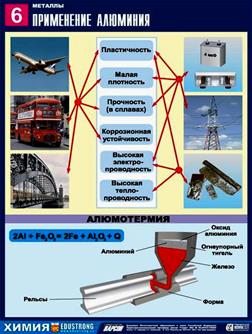
Высокая тепло - и электропроводность, пластичны;
Низкие t пл.; t кип; ρ
t пл. Li =189,50 C; t кип Li. =13170 C; ρL i= 0,534г/см
t пл. Na =97,830 C; t кип. Na = 882,90 C; ρNa = 0,968г/см
t пл. K =63,550 C; t кип. K = 7600 C; ρK = 0,962г/см
t пл. Rb =38,90 C; t кип. Rb =7030 C; ρRb =1,525г/см
t пл. Сs =28,50 C; t кип. Сs = 7050 C; ρСs = 1,90г/см









 Соединения окрашивают пламя:
Соединения окрашивают пламя:
 У
С
И
Л
Е
Н
И
Е
У
С
И
Л
Е
Н
И
Е


 Соединения окрашивают пламя:
Соединения окрашивают пламя:



 У
С
И
Л
Е
Н
И
Е
У
С
И
Л
Е
Н
И
Е