История координационной химии – фактически история самой химии, поскольку до определенного времени человечество оперировало с комплексными соединениями, даже не подозревая об этом. Становление и развитие координационной теории тесно переплетается с эволюцией ряда понятий, гипотез и учений различных отраслей химии.
Вместе с тем, КС – это самостоятельная, отдельная область химии со своим настоящим, прошлым и будущим.
С древнейших времен до начала XVIII века ученые и ремесленники использовали и даже синтезировали КС, хотя и неосознанно. Именно в этот первый период химия КС неотделима от химии в целом.
С начала XVIII века до 1893 г. идет направленный синтез КС и появляются многочисленные теории, стремящиеся объяснить их строение и свойства.
Третий период – с 1893 по 1940г. – создание, обоснование и победа координационной теории А.Вернера.
Четвертый период – современный с 1940г. по настоящее время – период укрепления и всестороннего развития координационной теории с использованием достижений и успехов химии, физики и математики.
1. Комплексные соединения и комплексные частицы (комплексы).
КС называют соединения, содержащие в своем составе сложные частицы «комплексы», образованные из реально существующих более простых частиц. Комплексы способны к самостоятельному существованию в узлах кристаллической решетки и растворе.
|
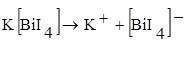
Комплексное Комплексная частица
Соединение (комплекс)
1. Комплексная частица образуется при диссоциации комплексного соединения, следовательно, самостоятельно существует в растворе (и в кристаллической решетке твердого КС).
2. Эта частица может быть получена из более простых реально существующих частиц:
|

Комплексная частица при написании ее формулы заключается в квадратные скобки.
Соли, типа KBiO3 не являются КС


|
2. 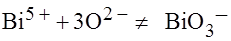
Этот ион не может быть получен из более простых частиц, т.к. ионов кислорода с зарядом (2-) в растворе не существует.
2. Координационная теория Вернера
Структура КС
Шведский ученый Вернер в 1893 г. сформулировал теорию комплексных соединений, основные положения которой практически в неизменном виде с некоторыми дополнениями дошли до наших дней.
 1. Все КС состоят из внутренней сферы, как правило, соединенной с внешней сферой.
1. Все КС состоят из внутренней сферы, как правило, соединенной с внешней сферой.
2. Внутренняя сфера состоит из центрального атома, называемого КОМПЛЕКСООБРАЗОВАТЕЛЬ
|

Чаще всего
Наиболее сильной комплексообразовательной способностью обладают d-элементы.
Вокруг М на небольшом расстоянии от него расположены (координированы) ЛИГАНДЫ, являющиеся нейтральными или заряженными частицами (молекулы, ионы).
Внутренняя сфера состоит из комплексообразователя и лигандов – это и есть комплексная частица или комплекс.
|
Внутренняя сфера может быть заряжена положительно, отрицательно или нейтрально.
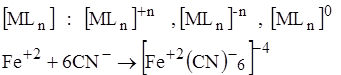
4. Число δ связей, образованных одним лигандом называется ДЕНТАНТНОСТЬЮ.
Различают: моно-, ди-, три-, тетра-, пента-дентантные лиганды и т.д. Как правило, дентантность не превышает 8.
Монодентантные:
1. H2O, NH3, CO;
2. Как правило, все однозарядные анионы H¯, OH¯, Cl¯, Br¯, CH3COO¯, NO2¯.
Дидентантные (бидентантные):
1. Большинство двухзарядных анионов S2¯, SO32¯, SO42¯, S2O32¯, CO22¯, C2O42¯
2. 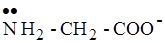 - однозарядный аннон глицина (глицинат анион)
- однозарядный аннон глицина (глицинат анион)
3.  - этилендиамин (en)
- этилендиамин (en)
Атом N способен образовывать две связи с металлом комплексообразователем по донорно-акцепторному механизму.
Лиганды, образующие две и более связей, называются ПОЛИДЕНТАНТНЫМИ.
Лиганды, присоединяющиеся к металлу комплексообразователю различными атомами, называются АМБИДЕНТАНТНЫМИ.
Например: CN¯, SCN¯, NO2¯ (ONO¯) – монодентантные.
|
КЧ равно сумме произведений количества всех лигандов на их дентантность.
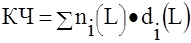
Пример: 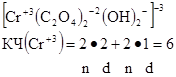
Если все лиганды в комплексной частице монодентантные, то КЧ равно количеству лигандов.
КЧ связано со степенью окисления металла комплексообразователя и, как правило, в два раза больше него.
| С.О. металла комплексообразователя | КЧ |
| + 1 | |
| + 2 | 4, 6 |
| + 3 | 6, 8 |
| + 4 | 8, 6 |
Т.е., как правило, КЧ является четным.
 6. Вокруг внутренней сферы на более далеком расстоянии от металла комплексообразователя находятся остальные ионы, образующие ВНЕШНЮЮ СФЕРУ.
6. Вокруг внутренней сферы на более далеком расстоянии от металла комплексообразователя находятся остальные ионы, образующие ВНЕШНЮЮ СФЕРУ.
Х – внешняя сфера.
Если комплексная частица заряжена положительно, то во внешней сфере находятся анионы.
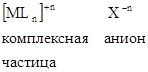
Если комплексная частица заряжена отрицательно, то во внешней сфере находятся катионы.
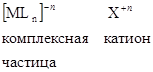
Если внутренняя сфера нейтральна, то Х (внешняя сфера) отсутствует.
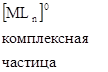
В данном случае комплексная частица (комплекс) и есть КС.
По формуле КС можно рассчитать С.О. металла комплексообразователя М, если известны заряды лигандов L и ионов внешней сферы X.
|
|

 7. Связь между М и L (М → L ) является ковалентной малополярной связью.
7. Связь между М и L (М → L ) является ковалентной малополярной связью.
|
8. Связь между ионами внешней сферы Х и внутренней сферой ионная.
Поэтому КС, содержащие внутреннюю и внешнюю сферы, в растворе полностью распадаются на ионы.
3. Пространственное строение КС
|
|
1. Гибридизация атома комплексообразователя
2. Перекрывание гибридных орбиталей М с орбиталями L. При этом металл комплексообразователь является акцептором электронных пар, а лиганды – донорами электронных пар, т.е. основаниями Льюиса.
Тип гибридизации определяет ориентацию связей М — L, а следовательно и пространственную конфигурацию комплексной частицы.
1). КЧ=2 sp гибридизация
характерно для однозарядных ионов М+n (Ag+, Cu+)
|

Линейное расположение sp гибридизованных орбиталей в пространстве приводит к линейной конфигурации комплексных соединений с КЧ = 2, т.к. М находится в sp гибридизации.
|
В первом случае в гибридизации принимают участие 1s и 3p орбитали.
Во втором – 1d, 1s и 1p орбитали.
В зависимости от типа гибридизации и от свойств М 4 гибридные орбитали располагаются в пространстве по-разному.
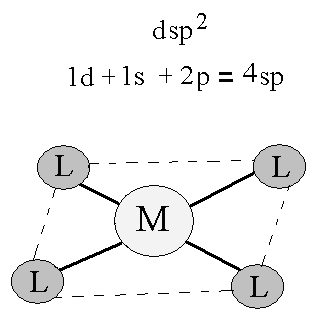
При dsp2 гибридизации орбитали в одной плоскости, поэтому комплексная частица имеет форму плоского квадрата.
Плоское строение имеют комплексы Pt+2, Pd+2
|
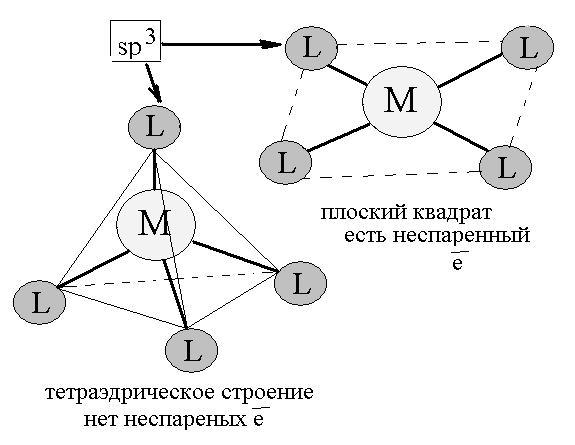
Такое строение имеют комплексы Zn+2, Hg+2, Co+2, Cd+2.
Плоскую конфигурацию комплексов Cu+2 (например 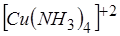 ) определяет наличие неспаренного электрона в ионе Cu+2.
) определяет наличие неспаренного электрона в ионе Cu+2.
Отсутствие неспаренных электронов в ионах Zn+2, Hg+2, Co+2, Cd+2 приводит к образованию тетраэдрических комплексов.
|
Наибольшие интерес представляют комплексы Fe+2, Fe+4, Co+3 поскольку их соединения применяются в медицине, а также они находятся в организме человека.
 Перед гибридизацией Fe+2 переходит в возбужденное состояние, для которого необходима затрата Е.
Перед гибридизацией Fe+2 переходит в возбужденное состояние, для которого необходима затрата Е.
Электроны занимают минимальное число орбиталей
Образующиеся гибридизованные располагаются в пространстве симметрично; при этом они направлены к вершинам октаэдра, а следовательно комплексная частица будет иметь октаэдрическую форму. При этом 4 лиганда будут находиться в одной плоскости, 5 – выше, 6 – ниже этой плоскости.
4. Классификация комплексных соединений
|
|

II. По природе L (лигандов) делятся НА:
1) аквакомплексы (L – H2O) 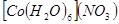
2) аммиачные комплексы (аммиакаты, аммины, амминокомплексы)
(L – NH3) 
3) карбонил-комплексы (L – СО) 
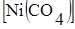
4) гидридо-комплексы (L –H¯) 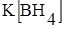
5) гидроксо-комплексы (L –ОH¯) 
6) ацидо-комплексы (L – кислоты, аминокислоты)
7) смешанные комплексы – содержат различные лиганды
8) внутрикомплексные соединения – хелатные КС (L – хеланты)
|
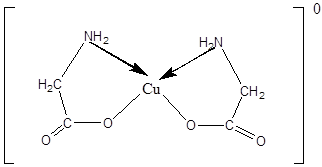

Связь между азотом и медью показывают стрелкой, направление которой указывает переход электронов от донора лиганда к акцептору комплексообразователю.
Хелатные соединения образуют циклические группировки атомов, причем более устойчивыми являются 5 и 6-ти членные циклы. Чем больше циклов содержит хелант, тем прочнее образуемое им соединение, а следовательно, хелатные соединения более прочные соединения, чем комплексы с обычными лигандами.
Гемоглобин и его производные, ферменты каталаза, пероксидаза, цитохромы – являются хелатными соединениями.
III. По электропроводности:
 1) Электролиты – катионные и анионные КС. При растворении в воде они полностью диссоциируют на ионы внешней и внутренней сферы, т.к. связь между ионами внешней сферы и внутренней сферой (комплексной частицей) ионная.
1) Электролиты – катионные и анионные КС. При растворении в воде они полностью диссоциируют на ионы внешней и внутренней сферы, т.к. связь между ионами внешней сферы и внутренней сферой (комплексной частицей) ионная.
|
2) Не электролиты – нейтральные КС, не содержат внешнюю сферу.
Отсутствие диссоциации внутренней сферы объясняется тем, что связь между М и L ковалентная малополярная.
[Pt(NH3)Br3]0≠
5. Номенклатура КС
Название КС должно быть составлено таким образом, чтобы по нему можно было написать только одну химическую формулу. Каждой химической формуле КС должно соответствовать только одно название.
Правила составления названий КС:
1. Название катионных и анионных КС должны состоять из 2-х слов: АНИОНА в Р.П. и КАТИОНА в Р.П.
2. Название нейтрального КС состоят из одного слова в И.П.

 X+a [Me nL0 mL±m]-a
X+a [Me nL0 mL±m]-a
II I
слово слово