Определение и строение молекул алкенов
Алкены – органические соединения, углеводороды алифатического (ациклического) непредельного характера, в молекуле которых между атомами углерода – одна двойная связь, и которые соответствуют общей формуле CnH2n.
Свое второе название - олефины - алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров - масел.
Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных углеводородов − алканов.
Простейший алкен: C2H4 или H – C = C – H этен или этилен,
| |
H H
А его радикал: C2H3- или CH2=CH- − винил.
Атомы углерода, между которыми есть двойная связь, 'находятся в состоянии sр2 −гибридизации. Это означает, что в гибридизации участвуют одна s - и две р -орбитали, а одна р -орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р -орбиталей соседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π-связи.




 |
 |
 |
σ
 |
-связь π-связь
 |
Три гибридные орбитали атома углерода, образующих двойную связь, одинаковы по форме и энергии, находятся в одной плоскости и направлены в углы равностороннего треугольника. Углы между гибридными орбиталями равны 120°. Негибридные орбитали, образующие π-связь, располагаются перпендикулярно плоскости молекулы.
Длина двойной связи 0,134нм (она короче одинарной, длина которой 0,154 нм), она более прочная, чем одинарная, так как ее энергия больше. Тем не менее, в углеродных соединениях π-связь значительно слабее, чем σ-связь и под воздействием реагентов π-связь легко разрывается. Наличие подвижной, легко поляризуемой π-связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.
Гомологический ряд алкенов
Гомологи − вещества, сходные по строению и свойствам и отличающиеся на одну гомологическую группу -СН2- или более.
Для первых трёх членов гомологического ряда алкенов используются исторически сложившиеся названия (их употребление зафиксировано правилами ИЮПАК): С2Н4 − этен, С3Н6 − пропен, С4Н8 − бутен. Начиная с пятого члена ряда и далее используются названия, корень которых производится от греческого или латинского названия соответствующего числительного с суффиксом –ен или –илен (обозначающий принадлежность соединения к данному классу): С5Н10 − пентен, С6Н12 − гексен, С7Н14 − гептен и т.д.
Атомы углерода могут соединяться не только в линейную цепь, но и в разветвленную. В ряду алкенов появление разветвления возможно начиная с бутена.
Номенклатура алкенов.
1. Выбор главной цепи. Образование названия углеводорода начинается с определения главной цепи - самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи. Нумерация атомов главной цепи начинается с того конца, с которого ближе расположены по старшинству (по преимуществу):
кратная связь → заместитель → углеводородный радикал.
Т.е. при нумерации в определении названия алкена положение кратной связи имеет преимущество перед остальными.
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.
3. Формирование названия., После корня, обозначающего числа атомов углерода в цепи, и суффикса –ен или -илен, обозначающий принадлежность соединения к классу алкенов, через в конце названия указывают местоположение двойной связи в углеродной цепи, т.е. номер атома углерода, у которого начинается двойная связь.
Если есть заместители, то в начале названия указывают цифры − номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди – два, три – три, тетра − четыре, пента − пять) и название заместителя (метил. этил, пропил). Затем без пробелов и дефисов − название главной цепи. Главная цепь называется как углеводород − член гомологического ряда этилена (этен (этилен), пропен, бутен и т.д.).
Пример:
CH3 Cl CH3
7 6| 5| 4| 3 2 1
CH3 – CH – CH – C – CH = CH – CH3
|
C2H5
4,6-диметил-4-этил-5-хлоргептен-2
Изомерия алкенов.
Для алкенов характерны следующие виды изомерии:
1. Структурная изомерия (простейший алкен, для которого характерны структурные изомеры, − это бутен):
а) изомерия углеродного скелета
1 2 3 4 5 1 2 3 4
CH2=CH – CH2 – CH2 – CH3 CH2=CH – CH – CH3
|
CH3
пентен-1 3-метилбутилен-1
б) изомерия положения кратной связи
1 2 3 4 5 1 2 3 4 5
CH2=CH – CH2 – CH2 – CH3 CH3–CH = CH – CH2 – CH3
пентен-1 пентен-2
в) изомерия положения заместителей (Hal, - NO2, SO2-OH и др.) (простейший алкен данного вида изомерии − это пропен)
1 2 3 4 5 1 2 3 4 5
CH2=CH – CH – CH2 – CH3 CH2=CH – CH2 – CH – CH3
| |
Cl Cl
3-хлорпентен-1 4-хлорпентен-1
2. Пространственная изомерия:
а) геометрическая изомерия
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии − геометрической, или цис- и транс-изомерии. Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости π-связи, а следовательно, и свойствами.
1 2 3 4
CH3 – CH = CH – CH3
бутилен-2
CH3 CH3 CH3 H
\ / \ /
C=C C=C
/ \ / \
H H H CH3
цис-изомер транс-изомер

При этом двойная связь не должна находиться у крайних атомов углерода углеродной цепи!
3. Межклассовая изомерия (с циклоалканами)
1 2 3 4 5
CH2=CH – CH2 – CH2 – CH3 CH2 – CH2
пентен-1 | |
CH2 CH2
\ /
CH2
циклопентан
Физические свойства алкенов.
C2H4 – C4H8 – газы, C5H10 – C16H32 - жидкости, C17H34 – … – твердые вещества. Алкены плохо растворимы в воде. Их температуры плавления и кипения закономерно повышаются при увеличении молекулярной массы соединения.
6. Химические свойства.
I. Реакции присоединения.
1. гидрирование
1 2 3
CH2=CH – CH3 + H – H → CH3 – CH2 – CH3
пропилен пропан
2. галогенирование
1 2 3
CH2=CH – CH3 + Br – Br → CH2 – CH – CH3
| |
Br Br
пропилен 1,2-дибромпропан
3. гидрогалогенирование (по правилу Марковникова: при присоединении веществ с полярной ковалентной связью типа HX (где X – это -Hal, -OH и т.д.) к несимметричным непредельным углеводородам по месту разрыва π-связи атом водорода присоединяется к наиболее гидрированному атому углерода, а X – к наименее гидрированному атому углерода)
1 2 3
CH2=CH – CH3 + H – Br → CH3 – CH – CH3
|
Br
пропилен 2- бромпропан
4. гидратация (по правилу Марковникова) с образованием вторичных спиртов (кроме этилена – у него образуется первичный спирт)
1 2 3
CH2=CH – CH3 + H – OH → CH2 – CH – CH3
|
OH
пропилен пропанол-2 (вторичный пропанол)
5. сульфирование (по правилу Марковникова) с образованием алкилсерных кислот
1 2 3
CH2=CH – CH3 + H–O – SO2OH → CH3 – CH – CH3
|
O – SO2OH
пропилен пропил-2серная кислота
CH3 – CH – CH3 + H–OH → CH3 – CH – CH3 + HO – SO2 – OH
| |
O – SO2OH OH
пропил2серная кислота пропанол-2 серная кислота
6. алкилирование
CH3 CH3 CH3 CH3
| | | |
CH3 – CH + CH2=C – CH3 → CH3 – C – CH2 – CH – CH3
| |
CH3 CH3
метилпропан метилпропен 2,2,4-триметилпентан (изооктан)
7. взаимное алкилирование (обратный процесс крекинга алкенов), при разных температурах образуются разные соединения

CH2=CH – CH2 – CH3 бутилен-1
CH3 – CH=CH – CH3 бутилен-2
Kt, t0
CH2=CH2 + CH2=CH2 ––→ CH2=C – CH3 метилпропилен
|
CH3
CH2=CH – CH=CH2 + H2 бутадиен-1,3
II. Реакции окисления.
1. горение
t0
C2H4 + 3 O2 (избыток) → 2 CO2 + 2 H2O
t0
C2H4 + 2 O2 (недостаток) → 2 CO + 2 H2O
t0
C2H4 + O2 (сильный недостаток) → 2 C + 2 H2O
2. частичное окисление кислородом воздуха с образованием эпоксидов (реакция Прилежаева)
t0, Ag
2 CH2=CH2 + O2 ––→2 CH2 – CH2
\ /
O
Этиленоксид (эпоксиэтан или окись этилена)
3. окисление кислородом окислителя в щелочной среде (реакция Вагнера)
из KMnO4
3 CH2=CH2 + [O] + H – OH ––––––––→ HO – CH2 – CH2 – OH
этиленгликоль (этандиол-1,2)
KOH
3 C-2H2=C-2H2 + 2 KMn+7O4 + 4 H2O ––→ 3 C-1H2 – C-1H2 + 2 Mn+4O2 + 2 KOH
| |
OH OH


 C2-2 -2ē → C2-1 3 3 C2-2 -6ē → 3 C2-1
C2-2 -2ē → C2-1 3 3 C2-2 -6ē → 3 C2-1
Mn+7 + 3ē → Mn+4 2 2 Mn+7 + 6ē → 2 Mn+4
Обесцвечивание щелочного раствора KMnO4 – это качественная реакция на непредельные углеводороды.
4. жесткое окисление кислородом более энергичного окислителя в кислой среде (кислый раствор KMnO4, HNO3, хромовая смесь) при нагревании
+H3O+, t°
R – CH=CH – R¢ + 4 [O] ––→ R – COOH + R¢ - COOH
СH3 – СH=CH – CH3 + 4 [O] ––→ 2 CH3 – COOH
бутилен-2 этановая (уксусная) кислота
CH3 – CH2 – CH=CH2 + 4 [O] ––→ CH3 – CH2 – COOH + HCOOH
бутилен-1 пропановая метановая (муравьиная)
кислота кислота

 HCOOH + [O] ––à HOCOOH (H2CO3)
HCOOH + [O] ––à HOCOOH (H2CO3)
метановая CO2↑ H2O
кислота угольная кислота
CH3 – CH2 – CH=CH – CH3 + 4 [O] ––→ CH3 – CH2 – COOH + CH3 – COOH
пентен-2 пропановая кислота этановая кислота
5 CH3–CH2–C-1H=C-1H–CH3 + 8 KMn+7O4 + 12 H2SO4 →4 K2SO4 + 8 Mn+2 SO4 + 12 H2O +
пентен-2
+ 5 CH3–CH2–C+3OOH + 5 CH3–C+3OOH
пропановая кислота этановая кислота


 C2-1 -8ē → 2 C+3 5 5 C2-2 -40ē → 10 C-1
C2-1 -8ē → 2 C+3 5 5 C2-2 -40ē → 10 C-1
Mn+7 + 5ē → Mn+2 8 8 Mn+7 + 40ē → 8 Mn+4
CH3 – CH2 – CH2 – CH=CH2 + 5 [O] ––→ CH3 – CH2 – CH2 – COOH + H2O + CO2
пентен-1 бутановая кислота
CH3 – CH2 – CH2 – C-1H=C-2H2 + 2 KMn+7O4 + 3 H2SO4 → K2SO4 + 2 Mn+2 SO4 + 4 H2O +
пентен-1
+ CH3 – CH2 – CH2 – C+3OOH + C+4O2


 бутановая кислота
бутановая кислота
 C-1 – 4ē → C+3 C-1 -4ē → C+3
C-1 – 4ē → C+3 C-1 -4ē → C+3
-10ē 1
C-2 – 6ē → C+4 C-2 -6ē → C+4
Mn+7 + 5ē → Mn+2 2 2 Mn+7 + 10ē → 2 Mn+2
III. Реакции полимеризации.
t0, kt, P
…+ CH2=CH2 + CH2=CH2 + …––––––→ …-CH2 – CH2 – CH2 – CH2-…
этилен полиэтилен
t0, kt, P
nCH2=CH2 ––––––→ (– CH2 – CH2 –)n
мономер структурное звено
где n – это степень полимеризации
t0, kt, P
n CH3 – CH=CH2 –––––––→ (– CH – CH2 –)n
|
CH3
пропилен полипропилен
IV. Реакции изомеризации.
550°C
CH2=CH2 – CH2 – CH3 ––––→ CH3 – CH = CH – CH3 + CH3 – C = CH2
|
CH3
бутен-1 бутен-2 метилпропен
V. Реакции отщепления (элиминирования)
а) до алкадиенов:
MgO, ZnO
CH2=CH – CH2 – CH3 ––––→ CH2 = CH – CH = CH2 + H2
бутен-1 бутадиен-1,3
б) до алкинов:
1200°C
2 CH2=CH2 ––––→ 2 CH≡CH + 2 H2
этен (этилен) этин (ацетилен)
Получение алкенов.
1. Крекинг нефтепродуктов
C16H34 → C8H18 + C8H16
гексадекан октан октен
Обычно образуется смесь различных углеводородов: например, при крекинге бутана конечными продуктами будет – смесь бутенов, пропилена, этилена и метана; при крекинге пропана – смесь пропилена, этилена и метана; при крекинге метилпропана – смесь метилпропилена, пропилена и метана.
2. Дегидрирование предельных углеводородов
 CH2 = CH – CH2 – CH3 бутен-1
CH2 = CH – CH2 – CH3 бутен-1
CH3 – CH2 – CH2 – CH3 →
бутан CH3 – CH = CH – CH3 бутен-2
550-650oc, Kt
2CH4 –––––––––––→ C2H4 + 2H2
3. Внутримолекулярная дегидратация спиртов
H2SO4, 140-150oC
CH3 – CH2 – OH ––––––––––––––––→ CH2 = CH2 + H2O
этанол этилен
4. Дегидрогалогенирование галогенпроизводных алканов (по правилу Зайцева: при отщеплении галогенводорода от вторичных и третичных галогеналканов атом водорода отщепляется от наименее гидрированного атома углерода)
Br
| спирт, to
CH3 – CH – CH2 – CH3 + NaOH –––––––→ CH3 – CH = CH – CH3 + NaBr + H2O
2-бромбутан бутен-2
5. Дегалогенирование дигалогенпроизводных алканов
Br Br
| |
CH3 – CH – CH – CH3 + Zn → CH3 – CH = CH – CH3 + ZnBr2
2.3-дибромбутан бутен-2
Применение алкенов
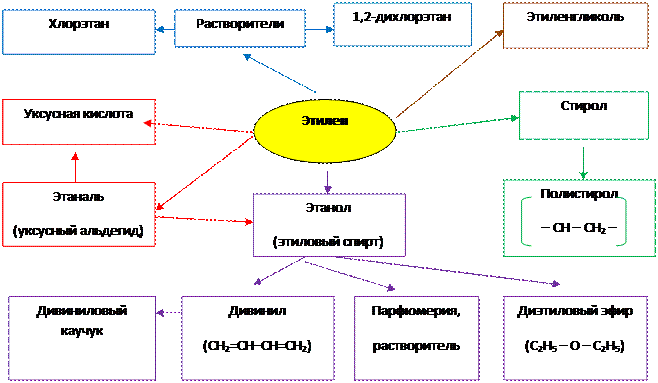
1. Применение этилена
 |
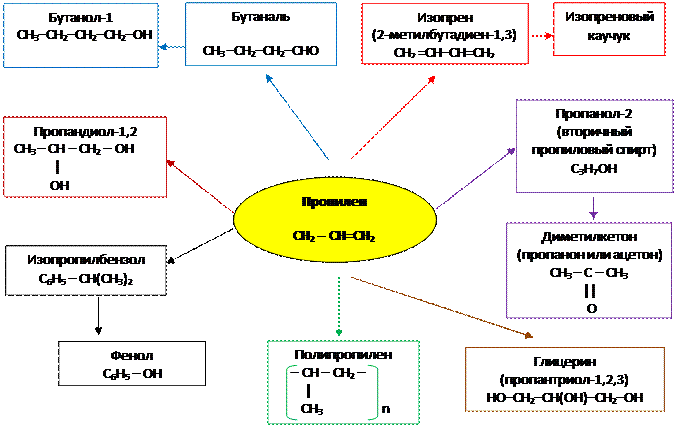
2. Применение пропилена
3. Применение изомеров бутилена
| |||||
| |||||
 |
Вопросы: (для контроля знаний)
1. Какие соединения относятся к алкенам?
2. Какое строение имеет молекулы алкенов (гибридизация, угол между гибридными орбиталями, длина связи)?
3. Как по правилами ИЮПАК образуется название неразветвлённого и разветвлённого алкена?
4. Какие виды изомерии характерны для алкенов?
5. В какие реакции присоединения может вступить пропен? Напишите уравнения реакций.
6. В какие реакции элиминирования может вступать алкены? Напишите уравнения реакций.
7. В какие реакции окисления может вступать алкены? Напишите уравнения реакций.
8. Какими способами можно получить алкены? Напишите уравнения реакций.
9. Какое применение нашли алкены?
Список используемых источников:
1. «Репетитор по химии (издание 15-ое)», под редакцией Егорова А. С., Феникс – Ростов-на-Дону, 2006
2. Габриелян О. С., Маскаев Ф. Н., Пономарев С. Ю., Теренин В. И. «Химия 10 класс: профильный уровень». (Учебник для общеобразовательных учреждений), Дрофа – Москва, 2005
3. Рудзитис Г. Е., Фельдман Ф. Г. «Химия 10: органическая химия (Учебник для 10 класса средней школы)», Просвещение – Москва, 1991