Тема: Молекулярно-кинетическая теория газов
Практическое занятие №1
Цель: рассмотреть механизм и алгоритм решения задач молекулярно-кинетической теории газов.
Основные формулы и определения
Наименьший размер молекулы – порядка 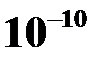 м, а наименьшая масса молекулы – 10–27кг.
м, а наименьшая масса молекулы – 10–27кг.
1. Количество вещества n (ню), моль. Один моль содержит Постоянную Авогадро молекул или атомов.
n = N/NА = m / М, гдеN — число молекул вещества, m — масса газа.
2.Постоянная Авогадро NA= 6,02. 1023 моль-1 — число молекул в одном моле.
3.Молярная масса M, кг/моль – это масса одного моля.
Определяется по таблице Менделеева, например Мо2=32.10–3 кг/моль.
Масса молекулы m0 = M / NA, где m0 — масса одной молекулы (атома).
Молярная масса вещества
M=m/ v,
где m — масса однородного тела (системы); v — количество вещества этого тела.
4. Связь молярной массы М с относительной молекулярной массой M r вещества
M= M rk,
где k=10-3 кг/моль.
5.Термодинамические параметры P, V, T — Определяют состояние вещества. P,Па — давление; V, м3 — объем; T,К (кельвин) — абсолютная (термодинамическая) температура T,K = 273 + t0C.
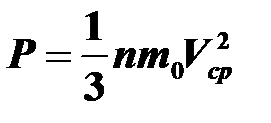
6.Основное уравнение молекулярно-кинетической теории связывает давление газа с массой и средней квадратичной скоростью молекулы.
n = N/V — концентрация молекул, N — число молекул,
Vср — средняя квадратичная скорость молекулы.
7.Физический смысл температуры. Абсолютная температура является мерой средней кинетической энергии молекул.
8.Средняя кинетическая энергия одноатомной молекулы 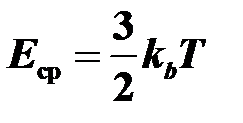 ,
,
kb = R/NA= 1,38.10 –23 Дж/К — постоянная Больцмана,
R = 8,31 Дж / моль×К — универсальная газовая постоянная.
9.Средняя квадратичная скорость молекул газа пропорциональна корню из абсолютной температуры 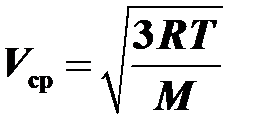 .
.
10.Уравнение состояния идеального газа (Менделеева - Клапейрона) связывает термодинамические параметры для любого состояния идеального газа:
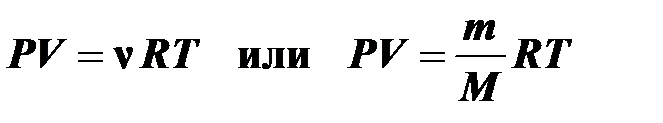 ,
,
R = 8,31 Дж /К моль — универсальная газовая постоянная.
11.Уравнение Клапейрона. Равенство выполняется при постоянной массе газа:
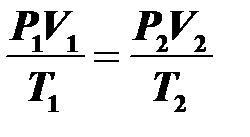 1 — первое 2 — второе состояние газа.
1 — первое 2 — второе состояние газа.
12. Закон Дальтона
p = p 1+ p 2+…+ p k,
13.Изохорный процесс (V=const) происходит при постоянном объеме и массе газа. Давление растет пропорционально абсолютной температуре 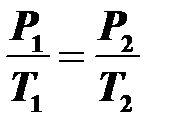 — закон Шарля.
— закон Шарля.
14.Изобарный процесс (P= const) происходит при постоянном давлении и массе газа. Объем растет пропорционально абсолютной температуре 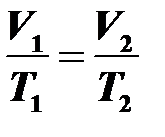 —закон Гей-Люссака.
—закон Гей-Люссака.
15.Изотермический процесс (T= const) происходит при постоянной температуре и массе газа. Давление уменьшается с увеличением объема 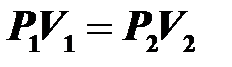 — закон Бойля–Мариотта.
— закон Бойля–Мариотта.
Алгоритм решения задач по молекулярно-кинетической теории газов
А.Исследование задачи:
Переписать условие.
Записать краткое условие, выразив все величины в единицах СИ.
В. Физическая часть решения:
Если газ не меняет своего состояния или меняется его масса, то, для определения его параметров, следует использовать уравнение Менделеева – Клапейрона.
Если даны два состояния и масса газа не меняется, то можно использовать уравнение Клапейрона или уравнение изопроцесса.
Если даны два состояния и масса газа меняется, то надо записать уравнение Менделеева – Клапейрона для каждого состояния.
Ненасыщенный пар подчиняется всем законам идеального газа, насыщенный ‑ уравнению Менделеева – Клапейрона.
Пункты С.D.E. совпадают с обычным алгоритмом.
Примеры решения задач
Пример 1. Определить молярную массу М углекислого газа СО2.
Решение. Молярную массу данного вещества можно определить по формуле
M= M rk, (1) где M r — относительная молекулярная масса вещества; k=10-3 кг/моль.
Относительную молекулярную массу найдем из соотношения
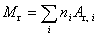 , (2)
, (2)
где пi — число атомов i -го химического элемента, входящих в молекулу данного вещества; A r, i — относительная атомная масса i -го химического элемента.
В нашем случае для углекислого газа формула (2) примет вид
M r =n C A r,C +n O A r,O (3) где n C=1 (число атомов углерода в молекуле углекислого газа); n O=2 (число атомов кислорода в той же формуле); A r,C и A r,O — относительные атомные массы углерода и кислорода.
По таблице Д. И. Менделеева найдем
A r,C=12, A r,O=16.
После подстановки в формулу (3) значений n C, n O, A r,C, и A r,Oполучим
M r = 1*12+2*16=44.
Подставив это значение относительной молекулярной массы, а также значение k в формулу (1), найдем молярную массу углекислого газа:
M =44*10-3 кг/моль =4,410-2 кг/моль.
Пример 2. Найти молярную массу М смеси кислорода массой m1=25 г и азота массой m2=75 г.
Решение. Молярная масса смеси М см есть отношение массы смеси т см к количеству вещества смеси v см т. е.
M см=mсм/ v см. (1)
Масса смеси равна сумме масс компонентов смеси mсм=m1+m2. Количество вещества смеси равно сумме количеств вещества компонентов.
Подставив в формулу (1) выражения mсм и v см, получим
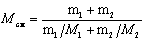
Применив способ, использованный в примере 1, найдем молярные массы M 1 кислорода и М 2, азота:
M 1 =3210-3 кг/моль, М 2=2810-3 кг/моль. Подставим значения величин во (2) и произведем вычисления:
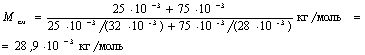
Пример 3. Определить: 1) число N молекул воды, занимающей при температуре t = 4°C объем V= 1 мм3; 2) массу m1 молекулы воды.
Решение. 1. Число N молекул, содержащихся в теле некоторой массы m, равно произведению постоянной Авогадро n a на количество вещества v: n = n a v. Так как v =m/ M, где М — молярная масса, то N=( m /M)n a. Выразив в этой формуле массу как произведение плотности на объем V, получим
N=( V /M) n a. (1)
Зная химическую формулу воды (Н2О), найдем молярную массу воды (см. пример 1):
M= M rk = (2*1+1*16)*10-3 кг/моль=18*10-3 кг/моль. Подставим значения величин в (1) и произведем вычисления:
N= [1*103*1*10-9/(18*10-3)] 6,02*1023 молекул=3,34.1019 молекул.
2. Массу одной молекулы воды найдем делением ее молярной массы на постоянную Авогадро: m1= M / n a Произведя вычисления по этой формуле, получим
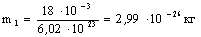 .
.
Пример 4. Определить число n молекул, содержащихся в объеме V = 1 мм3 воды и массу m0 молекулы воды.
Решение:
Число молекул n, содержащихся в теле некоторой массы m:
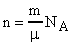 , где - молярная масса. Так как
, где - молярная масса. Так как 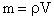 , где - плотность воды, то:
, где - плотность воды, то: 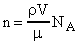 .
.
Расчет в СИ: V = 10-9 м3; = 103 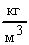 ; NA = 6,021023
; NA = 6,021023 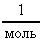 ; = 1810-3
; = 1810-3 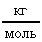 ; n =
; n = 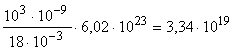 молекул.
молекул.
m0 подсчитываем по формуле (3) 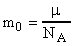 ;
; 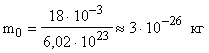 .
.
Пример 5. Определить число молекул содержащихся в 10 г азота.
Решение:
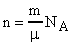
Расчет в СИ:
m = 10 г = 10-2 кг; = 2810-3  ; NA = 6,021023
; NA = 6,021023  ;
; 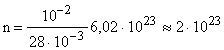 молекул.
молекул.
Пример 6. Чему равна масса молекулы водорода, если его молярная масса M =2 г/моль?
Решение
В одном моле содержится постоянная Авогадро молекул, поэтому: 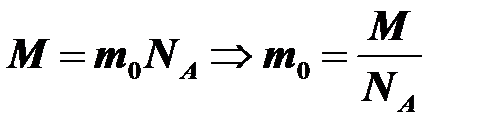 .
.
Вычисления 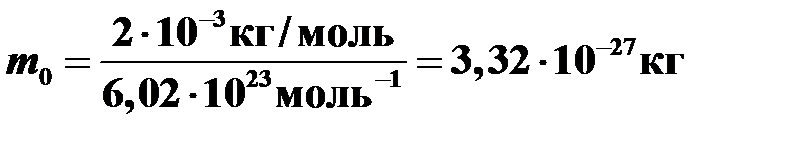 .
.
Ответ: 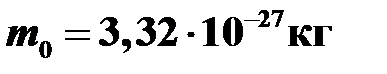 .
.
Пример 7. Какое количество атомов содержится в 2,7 кг алюминия? Молярная масса алюминия m = 27 г/моль. Молекула алюминия состоит из одного атома.
Решение
Количество вещества можно определить по формулам
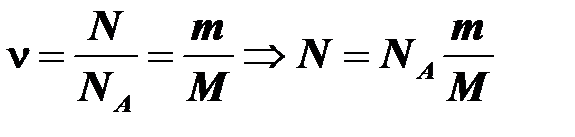 .
.
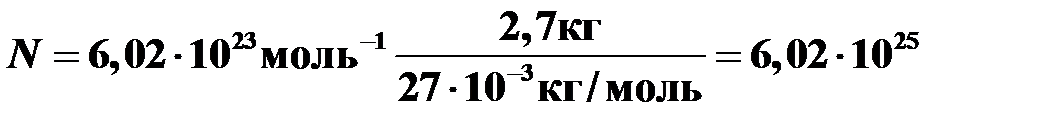 .
.
Ответ: 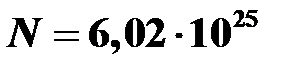 .
.
Пример 8.
Найти среднеквадратичную скорость молекул идеального газа, если его плотность равна 3 кг/м3, а давление – 1 МПа.
Решение
Воспользуемся основным уравнением молекулярно-кинетической теории: 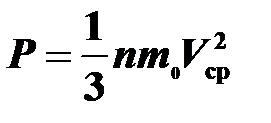 , где n = N/V — концентрация молекул,. V ср — средняя квадратичная скорость молекулы, N — число молекул,
, где n = N/V — концентрация молекул,. V ср — средняя квадратичная скорость молекулы, N — число молекул,  объем газа,
объем газа, 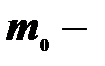 масса молекулы. Тогда,
масса молекулы. Тогда, 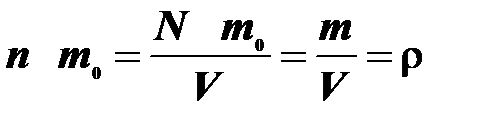 ,
, 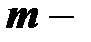 масса газа,
масса газа, 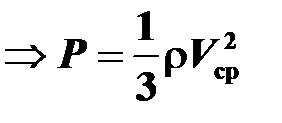 , получаем:
, получаем:
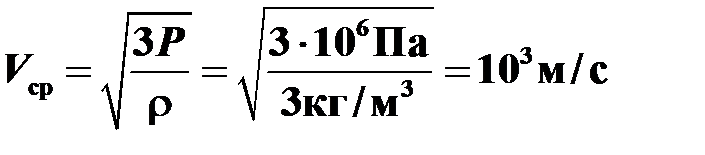 .
.
Ответ: 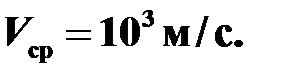
Пример 9
Найти среднеквадратичную скорость молекул водорода при температуре 17°С. Молярная масса водорода М = 2 г/моль.
Воспользоваться формулой 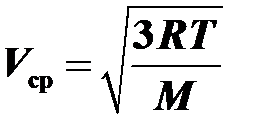 .
.
Ответ: 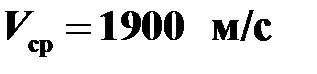 .
.
Пример 10
Найти концентрацию молекул кислорода при давлении 0,2 МПа, если среднеквадратичная скорость его молекул 700 м/с. Молярная масса кислодорода М = 32 г/моль.
Решение
Воспользуемся основным уравнением молекулярно-кинетической теории: 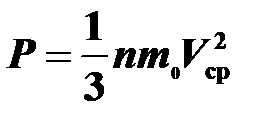 . В одном моле содержится постоянная Авогадро молекул, поэтому:
. В одном моле содержится постоянная Авогадро молекул, поэтому:
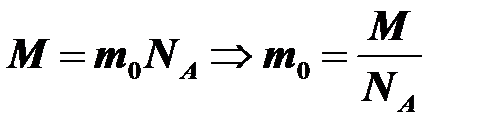 .
.
Подставляя 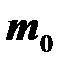 в
в  , получаем
, получаем 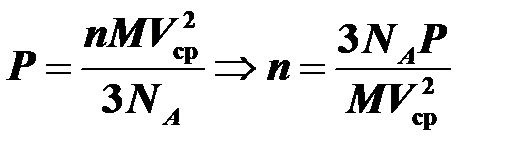 .
.
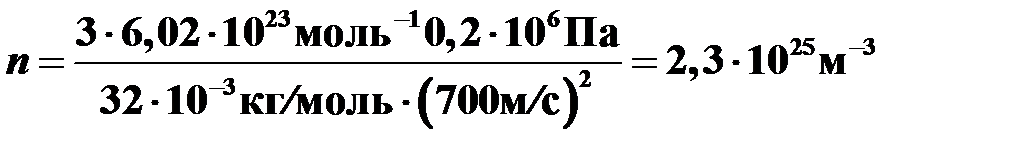 .
.
Ответ: 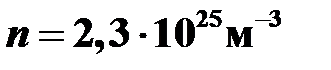 .
.
Пример 11.
Найти среднюю кинетическую энергию молекулы одноатомного газа при давлении
20 кПа и концентрации молекул 3×1025 м –3.
Решение
Воспользуемся основным уравнением молекулярно-кинетической теории: 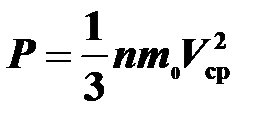 . Уравнение можно записать в виде
. Уравнение можно записать в виде 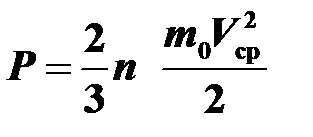 или
или 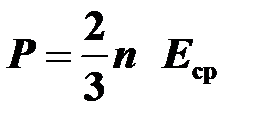 , где
, где 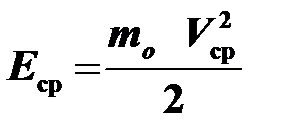 — средняя кинетическая энергия молекулы.
— средняя кинетическая энергия молекулы.
Тогда, 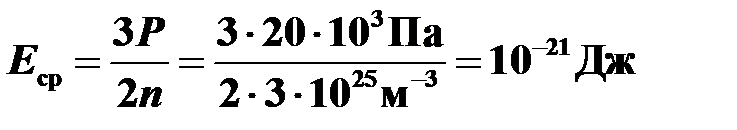 .
.
Ответ: 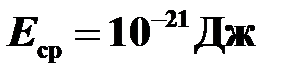 .
.
Пример 12.
Найти среднюю кинетическую энергию молекулы одноатомного газа при температуре 27°С.
Решение
Абсолютная температура является мерой средней кинетической энергии поступательного движения молекулы:
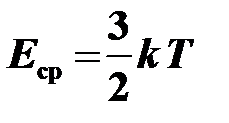 , где
, где 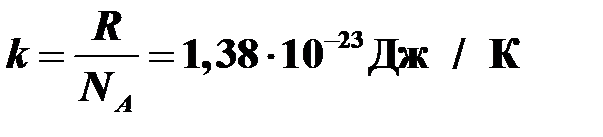 — постоянная Больцмана.
— постоянная Больцмана. 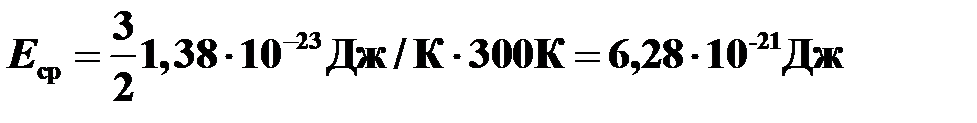 .
.
Ответ: 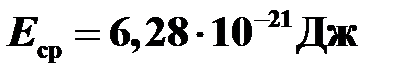 .
.
Пример 13
Какой объем занимает 10 моль идеального газа при давлении 10 МПа и температуре 27°С?
Решение
Воспользуемся уравнением Менделеева – Клапейрона 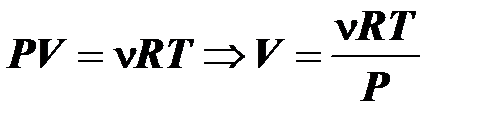 , где
, где  ‑
‑
универсальная газовая постоянная.
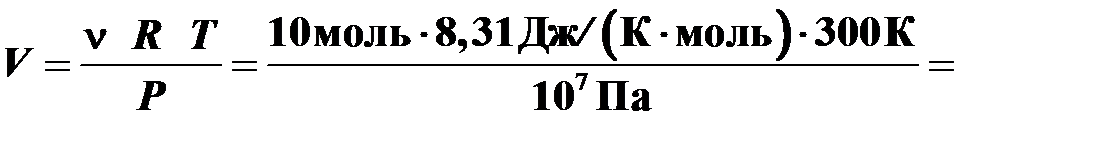
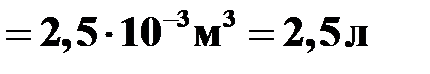 .
.
Ответ: V= 2,5 л.
Пример 14
Какое количество вещества содержится в 49 л газа при давлении 200 кПа и температуре 240 К?
Решение
Воспользуемся уравнением Менделеева–Клапейрона
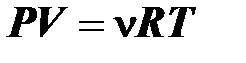
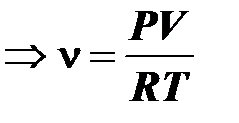 .
.
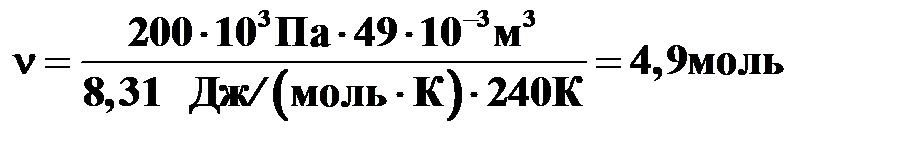 .
.
Ответ: 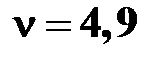 моль.
моль.
Пример 15
Имеется 12 л углекислого газа при давлении 900 кПа и температуре 127°С. Найти массу газа. Молярная масса углекислого газа М=44 г/моль.
Решение
Воспользуемся уравнением Менделеева–Клапейрона:
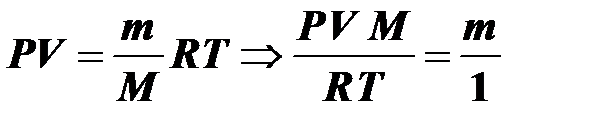 , где
, где
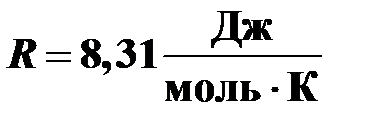 ‑ универсальная газовая постоянная.
‑ универсальная газовая постоянная.
Вычисления:
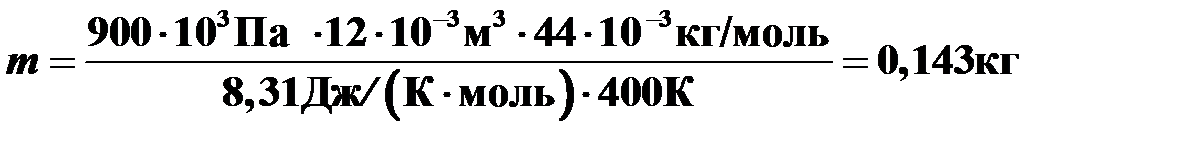 .
.
Ответ: 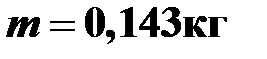 .
.
Пример 16.
Газ находится в закрытом баллоне под давлением 1 МПа при температуре 27°С. До какой температуры его можно нагреть, если баллон выдерживает давление не больше 3 МПа?
Решение
Процесс изохорный, поэтому уравнение Клапейрона имеет следующий вид: 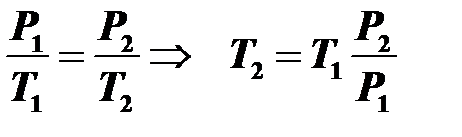 .
.
Вычисления:  .
.
Ответ: 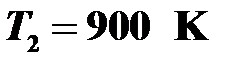 .
.
Пример 17.
Найти начальную температуру газа в закрытом баллоне, если при нагревании на 140 К давление газа возросло в 1,5 раза.
Решение
Процесс изохорный, поэтому уравнение Клапейрона имеет следующий вид: 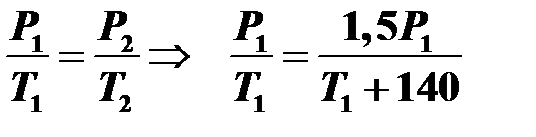
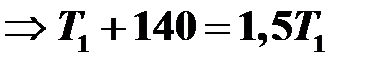
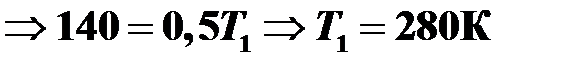 .
.
Ответ: 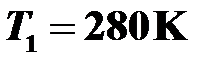 .
.
Пример 18
При увеличении абсолютной температуры в изобарном процессе в 1,4 раза объем увеличился на 40 см3. Найти первоначальный объем.
Решение.
Процесс изобарный, поэтому уравнение Клапейрона имеет следующий вид:
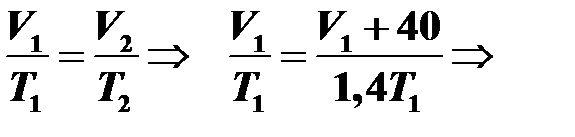
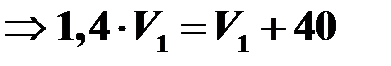
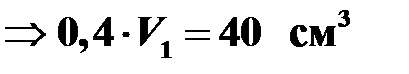
 .
.